题目内容
【题目】减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求。
(1)在原子经济学原则引导下,化学家用CO与H2在加热加压条件合成了液体燃料甲醇,其化学反应方程式___。
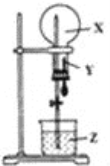
(2)以甲醇做燃料的电池,如图所示,其负极是___(填a或b),负极的反应式为___,正极的反应式为___。该燃料电池在理想状态下,将有96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,则通常甲醇燃烧的热化学反应方程式为___。

【答案】CO+2H2![]() CH3OH b CH3OH﹣6e﹣+H2O=CO2+6H+ O2+4e﹣+4H+═2H2O CH3OH(l)+
CH3OH b CH3OH﹣6e﹣+H2O=CO2+6H+ O2+4e﹣+4H+═2H2O CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=﹣727.6kJ/mol
O2(g)=CO2(g)+2H2O(l)△H=﹣727.6kJ/mol
【解析】
(1)根据CO与H2在加热加压条件合成了液体燃料甲醇,其化学反应方程式:CO+2H2![]() CH3OH;
CH3OH;
(2)燃料电池中通入燃料的一极为负极,故b是负极,a是正极;负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,该燃料电池的电解质溶液呈酸性,所以负极上甲醇失电子和水反应生成二氧化碳和氢离子,负极反应式为CH3OH-6e-+H2O=CO2+6H+,氧气在正极上生成水,正极电极反应式为:O2+4e-+4H+═2H2O;
96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,燃烧1mol液体甲醇放出热量为702.1kJ÷96.5%=727.6kJ,其热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=﹣727.6kJ·mol-1。
O2(g)=CO2(g)+2H2O(l)△H=﹣727.6kJ·mol-1。

练习册系列答案
相关题目