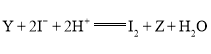题目内容
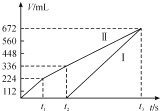
【题目】8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是
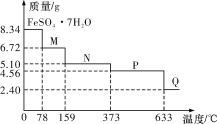
A.温度为78 ℃时固体物质M的化学式为FeSO4·5H2O
B.温度为159 ℃时固体N的化学式为FeSO4·2H2O
C.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时只得到一种无色气体生成
D.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
【答案】D
【解析】
8.34 g FeSO4·7H2O样品的物质的量为![]() =0.03mol,其中m(H2O)=0.03mol×7×18g/mol=3.78g,如果晶体失去全部结晶水,固体的质量应为8.34g-3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水,以此分析。
=0.03mol,其中m(H2O)=0.03mol×7×18g/mol=3.78g,如果晶体失去全部结晶水,固体的质量应为8.34g-3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水,以此分析。
A.温度为78℃时,固体质量为6.72g,其中m(FeSO4)= 0.03mol×152g/mol=4.56g,m(H2O)=6.72g-4.56g=2.16g,n(H2O)=![]() =0.12mol,n(H2O):n(FeSO4)=0.12mol:0.03mol=4:1,则M的化学式为FeSO4·4H2O,故A错误;
=0.12mol,n(H2O):n(FeSO4)=0.12mol:0.03mol=4:1,则M的化学式为FeSO4·4H2O,故A错误;
B.温度为159 ℃时,固体N的质量为5.10g,其中m(FeSO4)= 0.03mol×152g/mol=4.56g,m(H2O)=5.10g-4.56g=0.54g,n(H2O)=![]() =0.03mol,n(H2O):n(FeSO4)=0.03mol:0.03mol=1:1,则N的化学式为FeSO4·H2O,故B错误;
=0.03mol,n(H2O):n(FeSO4)=0.03mol:0.03mol=1:1,则N的化学式为FeSO4·H2O,故B错误;
C.加热至633℃时,固体质量为2.40g,其中n(Fe)= n(FeSO4·7H2O)=0.03mol,m(Fe)= 0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,n(O)=![]() =0.045mol,n(Fe):n(O)=0.03mol:0.045mol=2:3,所以固体Q的化学式为Fe2O3,则由P的得到Q的化学方程式为2FeSO4
=0.045mol,n(Fe):n(O)=0.03mol:0.045mol=2:3,所以固体Q的化学式为Fe2O3,则由P的得到Q的化学方程式为2FeSO4![]() Fe2O3+SO2↑+SO3↑,得到2种无色气体,故C错误;
Fe2O3+SO2↑+SO3↑,得到2种无色气体,故C错误;
D. 根据以上分析,N为FeSO4·H2O,P为FeSO4,在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O,故D正确。
FeSO4+H2O,故D正确。
答案选D。