题目内容
【题目】常温下,改变0.1 molL-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() (X)随pH的变化如图所示[已知]
(X)随pH的变化如图所示[已知]![]() (X)=
(X)=![]() 。下列叙述错误的是( )
。下列叙述错误的是( )
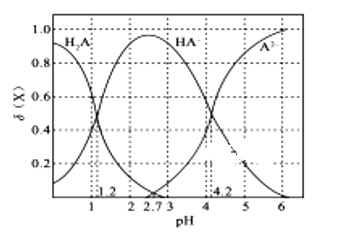
A.pH=1.2时, c(K+)+c(H+)=c(H2A) + c(OH-)+2c(A2-)
B.常温下,H2A的电离平衡常数Ka2 =10-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.KHA溶液中粒子浓度为c(K+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-)
【答案】D
【解析】
由图象可知,pH=1.2时,c(H2A)=c(HA-),pH=2.7时,c(H2A)=c(A2-),pH=4.2时,c(HA-)=c(A2-),随着pH的增大,c(H2A)逐渐减小,c(HA-)先增大后减小,c(A2-)逐渐增大,结合电离平衡常数以及题给数据计算,可根据纵坐标比较浓度大小,以此解答该题。
A、由图象可知pH=1.2时,H2A与HA-的曲线相交,则c(H2A)=c(HA-),溶液中存在电荷守恒得到,c(K+)+c(H+)=2c(A2-)+c(HA-)+c(OH-)=2c(A2-)+c(H2A)+c(OH-),故A正确;
B、pH=4.2时,c(H+)=10-4.2mol/L,c(HA-)=c(A2-),Ka2=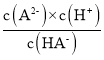 =10-4.2,,故B正确;
=10-4.2,,故B正确;
C、由图象可知,pH=2.7时,c(H2A)=c(A2-),由纵坐标数据可知:c(HA-)> c(H2A)=c(A2-),故C正确;
D、H2A的Ka1=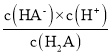 =10-1.2,故A2-的Kh2=
=10-1.2,故A2-的Kh2=![]() =10-12.8,HA-的电离常数大于其水解常数,KHA溶液pH小于7,溶液显酸性,溶液中离子浓度为:c(K+)>c(HA-)>c(H+)>c(A2-)>c(OH-)>c(H2A),故D错误;
=10-12.8,HA-的电离常数大于其水解常数,KHA溶液pH小于7,溶液显酸性,溶液中离子浓度为:c(K+)>c(HA-)>c(H+)>c(A2-)>c(OH-)>c(H2A),故D错误;
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】按要求答题
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是________
(2)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:
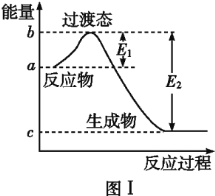
①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。NO2和CO反应的热化学方程式为________。
②下表所示是部分化学键的键能参数:
化学键 | P—P | P—O |
|
|
键能/(kJ·mol-1) | a | b | C | x |
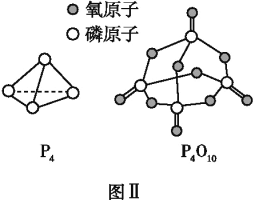
已知P4(g)+5O2(g)P4O10(g)ΔH=-dkJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x=________(用含a、b、c、d的代数式表示)。
(3)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。燃烧时释放大量的热并快速产生大量气体。已知在101kPa、298K时,1mol液态N2H4在O2中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是________。
又知:H2O(g)=H2O(l)ΔH=-44kJ·mol-1,若1mol液态N2H4在O2中完全燃烧生成N2和液态水,则放出的热量为________kJ。