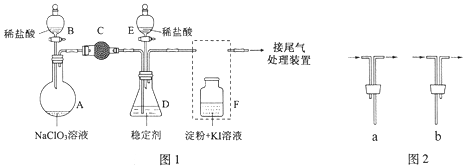
题目内容
【题目】铜能与浓硫酸在加热条件下反应,反应方程式为:
_____Cu +____H2SO4(浓) ![]() _____CuSO4 +____SO2↑+_____H2O
_____CuSO4 +____SO2↑+_____H2O
(1)配平上述方程式,并用双线桥法分析电子转移的方向和数目___________(在答题卷上的方程式中表示);
(2)该反应中还原剂为___________,氧化产物为__________;
(3)该反应中浓H2SO4体现____________性;
(4)还原剂与氧化剂的物质的量之比为______,标况下若生成SO2的体积为11.2 L,则反应时转移的电子为_______ mol。
【答案】1 2 1 2 2  +2H2O Cu CuSO4 酸性和氧化性 1:1 1mol
+2H2O Cu CuSO4 酸性和氧化性 1:1 1mol
【解析】
结合元素化合价的变化,根据氧化还原反应的理论分析解答即可。
(1)在 Cu+H2SO4(浓)![]() CuSO4+SO2↑+H2O中Cu元素化合价从0价升高为+2价,S元素从+6价降为+4价,结合电子守恒和原子守恒即可配平得到Cu+2H2SO4(浓)
CuSO4+SO2↑+H2O中Cu元素化合价从0价升高为+2价,S元素从+6价降为+4价,结合电子守恒和原子守恒即可配平得到Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,用双线桥法分析电子转移的方向和数目为
CuSO4+SO2↑+2H2O,用双线桥法分析电子转移的方向和数目为 ;
;
(2)该反应中Cu元素化合价升高,发生氧化反应,则还原剂为Cu,氧化产物为CuSO4;
(3)该反应中部分S元素从+6价降为+4价,即部分硫酸作氧化剂,则浓H2SO4体现酸性和氧化性;
(4)参加反应的硫酸物质的量的![]() 作氧化剂,则还原剂与氧化剂的物质的量之比为1:1,反应中S元素从+6价降为+4价,标况下11.2 L SO2的物质的量为
作氧化剂,则还原剂与氧化剂的物质的量之比为1:1,反应中S元素从+6价降为+4价,标况下11.2 L SO2的物质的量为![]() =0.5mol,则反应时转移的电子物质的量为0.5mol×2=1mol。
=0.5mol,则反应时转移的电子物质的量为0.5mol×2=1mol。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案【题目】按要求答题
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是________
(2)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:

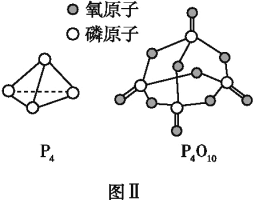
①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。NO2和CO反应的热化学方程式为________。
②下表所示是部分化学键的键能参数:
化学键 | P—P | P—O |
|
|
键能/(kJ·mol-1) | a | b | C | x |
已知P4(g)+5O2(g)P4O10(g)ΔH=-dkJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x=________(用含a、b、c、d的代数式表示)。
(3)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。燃烧时释放大量的热并快速产生大量气体。已知在101kPa、298K时,1mol液态N2H4在O2中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是________。
又知:H2O(g)=H2O(l)ΔH=-44kJ·mol-1,若1mol液态N2H4在O2中完全燃烧生成N2和液态水,则放出的热量为________kJ。