题目内容
(14分)超细铜粉主要应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:

试回答下列问题:
(1)下列关于[Cu(NH3)4]SO4的说法中,正确的有__________。(填字母序号)
(2)NH4CuSO3中的金属阳离子的核外电子排布式为_______________。
(3)SO2–3 离子中S硫原子的杂化方式为________,与其互为等电子体的一种分子的分子式是___________。
(4)NH3易液化的原因是___________________。
(5)右图是铜的某种氧化物的晶胞结构示意图,由此可确定该氧化物的化学式为__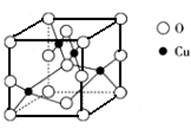 ___________。
___________。
(6)NH4CuSO3与硫酸微热反应的离子方程式为__________________________。

试回答下列问题:
(1)下列关于[Cu(NH3)4]SO4的说法中,正确的有__________。(填字母序号)
| A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键 |
| B.[Cu(NH3)4]SO4含有NH3分子,其水溶液中也含有NH3分子 |
| C.[Cu(NH3)4]SO4的组成元素中第一电离能最大的是氧元素 |
| D.[Cu(NH3)4]SO4的外界离子的空间构型为正四面体 |
(3)SO2–3 离子中S硫原子的杂化方式为________,与其互为等电子体的一种分子的分子式是___________。
(4)NH3易液化的原因是___________________。
(5)右图是铜的某种氧化物的晶胞结构示意图,由此可确定该氧化物的化学式为__
 ___________。
___________。(6)NH4CuSO3与硫酸微热反应的离子方程式为__________________________。
(14分)
(1) AD(2分)
(2) [Ar]3d10(2分)
(3) sp3、NF3(或PF3、NCl3、PCl3等)( 各2分)
(4) NH3分子间可形成氢键。(2分)
(5) CuO(2分)
(6)2NH4CuSO3 + 4H+ 2NH4+ + Cu2+ + Cu + 2SO2↑ + 2H2O(2分)
2NH4+ + Cu2+ + Cu + 2SO2↑ + 2H2O(2分)
(1) AD(2分)
(2) [Ar]3d10(2分)
(3) sp3、NF3(或PF3、NCl3、PCl3等)( 各2分)
(4) NH3分子间可形成氢键。(2分)
(5) CuO(2分)
(6)2NH4CuSO3 + 4H+
 2NH4+ + Cu2+ + Cu + 2SO2↑ + 2H2O(2分)
2NH4+ + Cu2+ + Cu + 2SO2↑ + 2H2O(2分)超细铜粉的某制备方法为:

(1)A.[Cu(NH3)4]SO4为络合物,NH3中包含极性共价键,与Cu2+形成配位键,铜铵络离子与硫酸根离子以离子键结合,正确
B.[Cu(NH3)4]SO4作为络合物,水溶液中可电离出铜铵络离子及硫酸根离子,不可能含有NH3分子,不正确
C.[Cu(NH3)4]SO4的组成元素中第一电离能最大的是氮元素,不正确
D.SO42—的中心原子S为sp3杂化,与四个O原子形成了正四面体的空间构型,正确
(2)Cu+为+1价亚铜离子,电子排布式为[Ar]3d10
(3)SO2–3 离子中S硫原子价键电子对是4,故为sp3杂化;
等电子体:原子总数及价电子总数均相等,例如NF3、PF3、NCl3、PCl3等
(4)NH3分子间可形成氢键,使其沸点较高,易液化
(5)晶胞中O原子个数: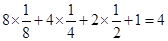 ,而铜原子为4个,即其化学式为CuO
,而铜原子为4个,即其化学式为CuO
(6)NH4CuSO3在酸性溶液中,亚硫酸根离子与氢离子可生成SO2及水及铵根离子,Cu+在酸性条件下发生岐化反应,可得到Cu2+ 、Cu,故离子方程式为:2NH4CuSO3 + 4H+ 2NH4+ + Cu2+ + Cu + 2SO2↑ + 2H2O
2NH4+ + Cu2+ + Cu + 2SO2↑ + 2H2O

(1)A.[Cu(NH3)4]SO4为络合物,NH3中包含极性共价键,与Cu2+形成配位键,铜铵络离子与硫酸根离子以离子键结合,正确
B.[Cu(NH3)4]SO4作为络合物,水溶液中可电离出铜铵络离子及硫酸根离子,不可能含有NH3分子,不正确
C.[Cu(NH3)4]SO4的组成元素中第一电离能最大的是氮元素,不正确
D.SO42—的中心原子S为sp3杂化,与四个O原子形成了正四面体的空间构型,正确
(2)Cu+为+1价亚铜离子,电子排布式为[Ar]3d10
(3)SO2–3 离子中S硫原子价键电子对是4,故为sp3杂化;
等电子体:原子总数及价电子总数均相等,例如NF3、PF3、NCl3、PCl3等
(4)NH3分子间可形成氢键,使其沸点较高,易液化
(5)晶胞中O原子个数:
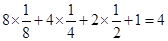 ,而铜原子为4个,即其化学式为CuO
,而铜原子为4个,即其化学式为CuO(6)NH4CuSO3在酸性溶液中,亚硫酸根离子与氢离子可生成SO2及水及铵根离子,Cu+在酸性条件下发生岐化反应,可得到Cu2+ 、Cu,故离子方程式为:2NH4CuSO3 + 4H+
 2NH4+ + Cu2+ + Cu + 2SO2↑ + 2H2O
2NH4+ + Cu2+ + Cu + 2SO2↑ + 2H2O
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目