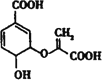
��Ŀ����
����Ŀ����֪�������ữ�IJ��ᣨH2C2O4����Һ����KMnO4��Һ��Ӧ��ij��ѧС���о����֣�����MnSO4�ɶԸ÷�Ӧ������ã�Ϊ��һ���о��й����ضԸ÷�Ӧ���ʵ�Ӱ�죬̽�����£�
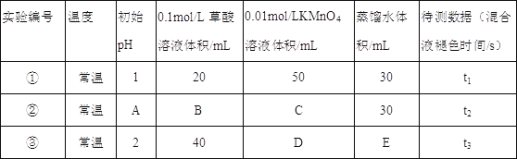
��1�������£�̽����ͬ�ij�ʼpH�Ͳ�����ҺŨ�ȶԷ�Ӧ���ʵ�Ӱ�죬�������ʵ�飬��A=____��C=____��E=_____��
��2���÷�Ӧ�����ӷ���ʽ______________________________________��
��3����t1��t2�������ʵ��ٺ͢ڵõ��Ľ�����_____________________________��
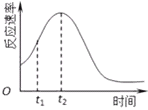
��4��С��ͬѧ����ÿ��ʵ�鷴Ӧ������ʱ��ı仯������ͼ������t1��t2ʱ�������ʱ�����Ҫԭ������ǣ���__________________����__________________________��
��5����ѧС���õζ����ⶨKMnO4��Һ���ʵ���Ũ�ȣ�ȡag���ᾧ�壨H2C2O42H2O��Ħ������126g/mol������ˮ���250mL��Һ��ȡ25.00mL��Һ������ƿ�У���������ϡH2SO4�ữ������KMnO4��Һ�ζ����յ㣬�ظ��ζ����Σ�ƽ������KMnO4��ҺVmL���ζ������յ�������ǣ�______________________________��ʵ��������Ķ���������__________________�����������ƣ�����KMnO4��Һ�����ʵ���Ũ��Ϊ____mol/L��
���𰸡�2 50 10 5H2C2O4+2MnO4��+6H+=10CO2��+2Mn2++8H2O ����������ͬʱ����Һ�ij�ʼpHԽС���÷�Ӧ�ķ�Ӧ����Խ�� �÷�Ӧ���� ����Mn2+�Ƿ�Ӧ�Ĵ��� �������һ��KMnO4��Һ����Һ��Ϊ��ɫ����30s�ں�ɫ����ȥ ������ƽ��250mL����ƿ������ʽ���ζ��� ![]()
��������
��1�����ݱȽ���������Է�Ӧ���ʵ�Ӱ�죬ֻ������һ��������ͬ����������������ͬȷ����
��2�������������ط�Ӧ���������ӺͶ�����̼��ˮ��
��3������pH��ͬ���Է�Ӧ���ʵ�Ӱ��ȷ����
��4�������¶Ⱥʹ����Է�Ӧ���ʵ�Ӱ�������
��5��������ر�������ɫ���ʲ���Ҫ����ָʾ��������������������ƽ������250mL��Һ��250mL����ƿ����ȡKMnO4��Һ�Ͳ�����Һ�õ���ʽ�ζ��ܣ����ù�ϵʽ�����м��㣻
��1�����ݸ�ʵ��̽����ͬ�ij�ʼpH�Ͳ�����ҺŨ�ȶԷ�Ӧ���ʵ�Ӱ�죬ʵ��Ҫ�����KMnO4��Һ��ʼŨ����ͬ����KMnO4��Һ�����Ϊ50mL�������Ϊ100mL����C=50��D=50��B=20��E=10��̽����������Է�Ӧ���ʵ�Ӱ�죬�豣֤����������ͬ��ͨ�����������֪����ڵ�pH��ͬ������۵IJ���Ũ�Ȳ�ͬ����A=2��
�𰸣�2��50��10��
��2�������������ط�Ӧ�������ӺͶ�����̼��ˮ���䷴Ӧ�����ӷ���ʽΪ��5H2C2O4+2MnO4-+6H+=10CO2��+2Mn2++8H2O��
�𰸣�5H2C2O4+2MnO4-+6H+=10CO2��+2Mn2++8H2O��
��3��ʵ��ٺ͢�ֻ��pH��ͬ��������������ͬ������t1<t2��˵������������ͬʱ����Һ�ij�ʼpHԽС���÷�Ӧ�ķ�Ӧ����Խ�죻
�𰸣�����������ͬʱ����Һ�ij�ʼpHԽС���÷�Ӧ�ķ�Ӧ����Խ�죻
��4�����ڸ÷�Ӧ��Ӱ�컯ѧ��Ӧ������ֻ���¶Ⱥʹ��������Է�Ӧ������ʱ��ı仯������ͼ������t1��t2ʱ�������ʱ�����Ҫԭ������ǣ���Ӧ���ȵ����¶��������Mn2+�Ƿ�Ӧ�Ĵ�����
�𰸣��÷�Ӧ���ȣ�����Mn2+�Ƿ�Ӧ�Ĵ�����
��5��������ر�������ɫ���ʲ���Ҫ����ָʾ�������ᷴӦ��ϣ��������һ��KMnO4��Һ����Һ��Ϊ��ɫ����ɫ30s�ڲ���ȥ��˵���ζ����յ㣻����������������ƽ������250ml��Һ��250mL����ƿ����ȡKMnO4��Һ�Ͳ�����Һ�õ���ʽ�ζ��ܣ�
c�����ᣩ=![]() =
=![]() mol/L
mol/L
�ɹ�ϵʽ 2KMnO4 �� 5H2C2O4
2 5
cmolL-1��V��10-3L ![]() mol/L��25��10-3mol
mol/L��25��10-3mol
c=![]() mol/L
mol/L
�𰸣��������һ��KMnO4��Һ����Һ��Ϊ��ɫ����30s�ں�ɫ����ȥ��������ƽ��250mL����ƿ������ʽ���ζ��ܣ�![]()