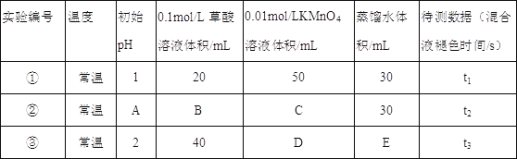
题目内容
【题目】甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系![]() 其它产物已略去
其它产物已略去![]() 。
。
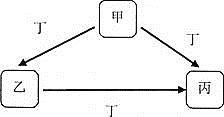
![]() 若丁为KOH溶液,写出乙的一种用途________,甲
若丁为KOH溶液,写出乙的一种用途________,甲![]() 丙的离子方程式为________。
丙的离子方程式为________。
![]() 若丁为Fe,写出向丙溶液中加入NaOH溶液的化学方程式:________;该实验现象为________。
若丁为Fe,写出向丙溶液中加入NaOH溶液的化学方程式:________;该实验现象为________。
![]() 若甲、乙、丙均为焰色反应呈黄色的化合物,则丁可能为________。
若甲、乙、丙均为焰色反应呈黄色的化合物,则丁可能为________。
【答案】![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ,
,![]() 生成的白色絮状沉淀迅速变为灰绿色,最后变为红褐色
生成的白色絮状沉淀迅速变为灰绿色,最后变为红褐色 ![]() 或
或![]()
【解析】
(1)若丁为KOH溶液,甲可为氯化铝,乙为氢氧化铝,丙为偏铝酸钠;
(2)若丁为Fe,甲可为硝酸,乙为硝酸铁,丙为硝酸亚铁;
(3)若甲、乙、丙均为焰色反应呈黄色的化合物,甲可为NaOH,丁可为CO2,乙为碳酸钠,丙为碳酸氢钠,如丁为SO2,乙为亚硫酸钠,丙为亚硫酸氢钠,以此解答该题。
(1)若丁为KOH溶液,根据题意,甲能和氢氧化钾反应,同时和丁反应可以分步,故甲为可溶性铝盐,氢氧化钾少量生成氢氧化铝沉淀,再滴加氢氧化钾沉淀溶解生成偏铝酸根离子,故乙为氢氧化铝,用途为医用胃酸中和剂;甲直接生成丙,是氢氧化钾过量直接生成偏铝酸根离子和水,离子方程式为:![]() ;故答案为:医用胃酸中和剂;
;故答案为:医用胃酸中和剂;![]() ;
;
(2)若丁为铁,说明甲为硝酸,铁不足生成乙为硝酸铁,铁过量生成丙为硝酸亚铁,铁离子和铁反应生成亚铁离子,硝酸亚铁和氢氧化钠反应生成氢氧化亚铁沉淀,氢氧化亚铁不稳定,很容易被氧气氧化为氢氧化铁,产生的现象为:生成的白色絮状沉淀迅速变为灰绿色,最后变为红褐色;故答案为:![]()
![]()
![]()
![]()
![]()
![]() ;
;![]() 生成的白色絮状沉淀迅速变为灰绿色,最后变为红褐色;
生成的白色絮状沉淀迅速变为灰绿色,最后变为红褐色;
(3)若甲、乙、丙均为焰色反应呈黄色的化合物,说明含有钠元素,甲可以是氢氧化钠,丁可以是二氧化碳或二氧化硫,乙为碳酸钠或亚硫酸钠,丙为碳酸氢钠或亚硫酸氢钠,故答案为:![]() 或
或![]() ;
;

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+2B2(g)![]() 2AB3(g) ΔH<0,相关数据如下表所示:
2AB3(g) ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol A2、2molB2 | 2molAB3 | 2mol AB3 |
反应物的转化率 | a甲 | a乙 | a丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时AB3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时AB3的反应速率/mol·L-1·min-1 | v甲 | v乙 | v丙 |
下列说法正确的是( )
A.v甲=v丙B.c乙<c丙C.a甲 +a乙<1D.K乙