题目内容
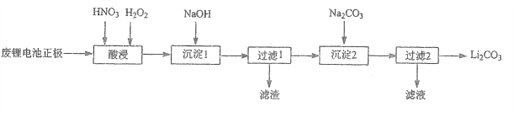
【题目】(1)工业上生产纯硅的工艺流程如下:
![]()
①石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是__________(填“氧化剂”或“还原剂”),生成气体的化学式为________;在该反应中,若消耗了3.0 g SiO2 ,则转移电子的总数为_______________。
②粗硅与氯气反应后得到沸点较低的液态四氯化硅,其中常混有一些高沸点、难挥发性液体杂质(与液态四氯化硅互溶),必须分离提纯。其提纯方法为____(填字母)。
A. 蒸馏 B. 过滤 C. 萃取 D. 蒸发
(2)向硫酸亚铁溶液中滴加氢氧化钠溶液,看到的现象是____________________,写出沉淀变化的化学方程式 ________________________________。
(3)把10.2 g镁铝合金的粉末放入500mL过量的稀盐酸中,得到11.2 L H2(标准状况下)求:①该合金中镁的质量为__________。
②反应后所得溶液中Al3+的物质的量浓度为__________ (假设反应前后溶液体积不变)。
【答案】还原剂 CO 1.204×1023 A 白色絮状沉淀迅速变成灰绿色,最后变为红褐色 4Fe(OH)2+O2 +2H2O=4Fe(OH)3 4.8g 0.4mol·L-1
【解析】
(1)二氧化硅和焦炭在高温下反应生成粗硅和CO,生成的粗硅和氯气化合生成四氯化硅,四氯化硅和氢气发生置换反应生成生成硅和氯化氢,据此解答。
(2)硫酸亚铁和氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁不稳定易被氧化,据此解答。
(3)镁铝均能与盐酸反应产生氢气,根据金属的质量和产生的氢气体积结合方程式计算。
(1)①石英砂的主要成分是SiO2,二氧化硅和焦炭在高温下反应生成粗硅和一氧化碳,碳元素化合价升高,失去电子,因此在制备粗硅时,焦炭的作用是还原剂,生成气体的化学式为CO;在该反应中,硅元素化合价从+4价降低到0价得到4个电子,若消耗了3.0 g SiO2,二氧化硅的物质的量是3.0g÷60g/mol=0.05mol,则转移电子的物质的量是0.05mol×4=0.2mol,电子总数为0.2mol×6.02×1023/mol=1.204×1023。
②粗硅与氯气反应后得到沸点较低的液态四氯化硅,其中常混有一些高沸点、难挥发性液体杂质(与液态四氯化硅互溶),必须分离提纯,由于二者的沸点相差较大,则其提纯方法为蒸馏法,答案选A。
(2)硫酸亚铁和氢氧化钠溶液发生复分解反应反应生成硫酸钠和氢氧化亚铁,氢氧化亚铁不稳定易被氧化,因此看到的现象是白色絮状沉淀迅速变成灰绿色,最后变为红褐色,沉淀变化的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)标况下11.2L氢气的物质的量是11.2L÷22.4L/mol=0.5mol,设合金中镁和铝的物质的量分别是xmol、ymol,则24x+27y=10.2。根据方程式Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑可知x+1.5y=0.5,解得x=0.2、y=0.2。
①该合金中镁的质量为0.2mol×24g/mol=4.8g。
②根据铝原子守恒可知反应后所得溶液中Al3+的物质的量浓度为0.2mol÷0.5L=0.4mol·L-1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 溴乙烷与氢氧化钠乙醇溶液共热,生成气体通入酸性高锰酸钾溶液中,褪色 | 有乙烯生成 |
B | 向试管中的浓硫酸加入铜片,盖好胶塞,导管通气入品红溶液,无明显现象 | 铜片未打磨 |
C | 除去CuSO4溶液中Fe2+:先加足量H2O2,再加Cu(OH)2调溶液pH=4 | Ksp[Cu(OH)2]>Ksp[Fe(OH)2] |
D | 将有色纸条放入盛满干燥氯气的集气瓶中,盖上玻璃片,无明显现象 | 氯气漂白不是Cl2分子直接作用的结果 |
A. A B. B C. C D. D