题目内容
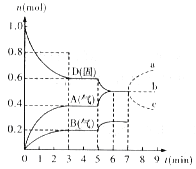
【题目】在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图:
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图:
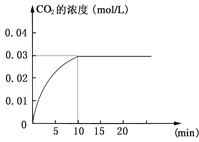
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=____________mol/L,该温度下的平衡常数K= (计算出结果)。
(2)判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的 CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
【答案】
(1)0.003mol/(L.min);0.03mol/L;9;
(2)①③;
(3)0.01mol/L。
【解析】
试题分析:(1)加入0.2mol的CO和0.2mol的H2O,则起始浓度c(CO)=c(H2O)=![]() =0.04mol/L,平衡时c(CO2)=0.03mol/L,则
=0.04mol/L,平衡时c(CO2)=0.03mol/L,则
CO(g) + H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度/molL-1 :0.04 0.04 0 0
转化浓度/molL-1 :0.03 0.03 0.03 0.03
平衡浓度/molL-1 :0.01 0.01 0.03 0.03
v(CO2)=![]() =
=![]() =0.003mol/(L.min),反应达到平衡状态时,c(CO2)=c(H2)=0.03mol/L,K=
=0.003mol/(L.min),反应达到平衡状态时,c(CO2)=c(H2)=0.03mol/L,K=![]() =
=![]() =9;故答案为:0.003mol/(L.min);0.03mol/L;9;
=9;故答案为:0.003mol/(L.min);0.03mol/L;9;
(2)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,①CO减少的速率和CO2减少的速率相等,该反应的正逆反应速率相等,所以该反应达到平衡状态,故正确;②根据图象知,该反应达到平衡状态时,c(CO2)=c(H2)=0.03mol/L,则c(CO)=c(H2O)=0.01mol/L,当CO、H2O、CO2、H2等浓度都相等时,该反应未达到平衡状态,故错误;③CO、H2O、CO2、H2的浓度都不再发生变化时,该反应达到平衡状态,故正确;④该条件下,可逆反应达到平衡状态时,正逆反应速率相等但不等于0,故错误;故选①③;
(3)如果一开始加入0.1mol的CO、0.1mol的H2O、0.1mol的CO2和0.1mol的H2,与开始时加入0.2mol CO和0.2mol H2O为等效平衡,则两种条件下,达到平衡状态时其水的物质的量浓度相等,所以达到平衡状态时,c(H2O)=![]() ═0.01mol/L,故答案为:0.01mol/L。
═0.01mol/L,故答案为:0.01mol/L。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案