题目内容
13.下列关于强弱电解质的说法中,正确的是( )| A. | Al2O3在熔化状态下全部电离,因而是弱电解质 | |
| B. | 具有极性键的共价化合物都是强电解质 | |
| C. | 具有非极性键的共价化合物都是弱电解质 | |
| D. | 所有弱酸、弱碱都是弱电解质 |
分析 A.根据强弱电解质的根本区别在于能够完全电离进行分析;
B.强极性共价化合物是否能在水溶液中完全电离是判断其是否为强电解质的标准;
C.强弱电解质的本质区别是在溶液中能否完全电离,与是否具有非极性键无关;
D.强酸、强碱及大部分盐类在水溶液中或熔融时能完全电离,是强电解质,所有弱酸、弱碱都是弱电解质.
解答 解:A.电解质的强弱是根据其电离程度划分的,完全电离的电解质是强电解质,Al2O3在熔化状态下全部电离,属于强电解质,故A错误;
B.具有强极性键的共价化合物在水溶液中可能完全电离,如氯化氢属于强电解质,但具有极性键的共价化合物不一定是强电解质,如氟的非金属性最强,HF强极性共价化合物,但HF在水溶液中部分电离,为弱电解质,故B错误;
C.苯磺酸属于强电解质,其碳碳键为非极性键,故C错误;
D.弱酸弱碱在水溶液中部分电离,属于弱电解质,故D正确;
故选D.
点评 本题考查了电解质强弱的判断,注意电解质强弱是根据其电离程度划分,注意明确强弱电解质的本质区别,明确溶液导电性、溶质的溶解度等与强弱电解质没有必然关系是高频考点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列实验设计能够成功的是( )
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$滴加$\stackrel{硝酸钡溶液}{→}$白色沉淀滴加$\stackrel{稀盐酸}{→}$沉淀不溶解-→说明试样已变质 | |
| B. | 除去粗盐中硫酸钙杂质:粗盐$\stackrel{溶解}{→}$足量$\stackrel{碳酸钠溶液}{→}$足量$\stackrel{氯化钡}{→}$溶液$\stackrel{过滤}{→}$滤液中$\stackrel{滴加}{→}$盐酸$\stackrel{结晶}{→}$精盐 | |
| C. | 检验某溶液中是否含有Fe2+试样$\stackrel{KSCN溶液}{→}$溶液颜色无变化$\stackrel{滴加氨水}{→}$溶液变红色-→溶液中含有Fe2+ | |
| D. | 证明酸性条件H2O2的氧化性比I2强:NaI溶液30%$\stackrel{H_{2}O_{2}}{→}$稀硝酸$\stackrel{淀粉}{→}$溶液变蓝色-→氧化性:H2O2>I2 |
4.乙酰水杨酸即阿斯匹林(aspirin)是一种解热止痛、治疗感冒药,实验室制取原理为:

实验方法:在干燥的锥形瓶中放入称量好的水杨酸(6.2g 0.045mol)、乙酸酐(5mL 5.4g 0.053mol),滴入5滴浓硫酸,在70℃反应一段时间,按如下流程分离出乙酰水杨酸.
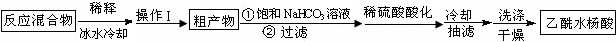
已知:①乙酰水杨酸溶于热水,在冷水中微溶;乙酸酐遇水生成乙酸.饱和NaHCO3溶液
②乙酰水杨酸钡、水杨酸钡均可溶于水.
(1)反应后用40mL冰水稀释反应混合物的操作是:待反应液稍冷后,在玻璃棒不断搅拌下将反应液沿烧杯壁慢慢倒入40ml冰水中.
(2)操作Ⅰ为过滤.
(3)判断粗产物与饱和碳酸氢钠反应完全的现象是:无气泡产生.
(4)某同学推测产品中可能还含有少量水杨酸和Na2SO4,设计了如下方案进行检验,实验证明不含杂质,请在答题卡上完成表中内容.
(5)产率计算:称量干燥后纯净产品质量为3.2g,该实验中乙酰水杨酸的产率计算表达式为$\frac{3.2}{0.045×180}$×100%,计算结果为40%(保留两位有效数字).(乙酰水杨酸的相对分子质量为180)

实验方法:在干燥的锥形瓶中放入称量好的水杨酸(6.2g 0.045mol)、乙酸酐(5mL 5.4g 0.053mol),滴入5滴浓硫酸,在70℃反应一段时间,按如下流程分离出乙酰水杨酸.
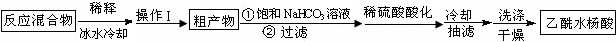
已知:①乙酰水杨酸溶于热水,在冷水中微溶;乙酸酐遇水生成乙酸.饱和NaHCO3溶液
②乙酰水杨酸钡、水杨酸钡均可溶于水.
(1)反应后用40mL冰水稀释反应混合物的操作是:待反应液稍冷后,在玻璃棒不断搅拌下将反应液沿烧杯壁慢慢倒入40ml冰水中.
(2)操作Ⅰ为过滤.
(3)判断粗产物与饱和碳酸氢钠反应完全的现象是:无气泡产生.
(4)某同学推测产品中可能还含有少量水杨酸和Na2SO4,设计了如下方案进行检验,实验证明不含杂质,请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将少量产品加入6mL水的试管A中,振荡,将上层液体倾析至B、C中. | 得到白色晶体和无色溶液 | |
| ② | 向试管B中,加入少量BaCl2溶液(或取试管B中溶液做焰色反应实验). 此空删去.此空删去 | 无白色沉淀生成 | 产品中不含SO42- |
| ③ | 向试管C中,加入少量FeCl3溶液(或浓溴水). 此空删去.此空删去 | 溶液不显紫色(或无白色沉淀出现). | 产品中不含水杨酸 |
18.下列叙述中,正确的是( )
| A. | 中和10mol0.1mol/L醋酸与中和100mL0.001mol/L醋酸所需同种碱的量不同 | |
| B. | 常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液中,由水电离产生的c(OH-)相等 | |
| C. | 向NH4Cl溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强 | |
| D. | 向饱和石灰水中加入少量CaO,恢复至室温后溶液中c(OH-)增大,导电能力增强 |
5.环境毒品“二恶英”是目前人类制造的剧毒的化学物质,其结构简式如图所示,它属于( )
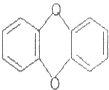

| A. | 高分子化合物 | B. | 芳香烃 | C. | 烃 | D. | 有机物 |
 回答下列问题:
回答下列问题: .
.