题目内容
2.用化学符号填空:(1)①盐酸、硫酸都能使紫色石蕊溶液变红的原因是溶液中都存在H+;
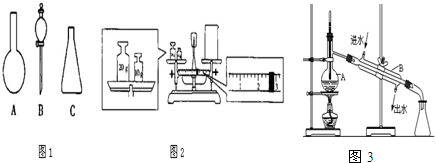
②高锰酸钾中锰元素的化合价+7.
(2)①盐酸除铁锈的反应方程式Fe2O3+6HCl═2FeCl3+3H2O;
②只选用一种溶液和金属丝、通过一次反应就能将铁、铜、银的活动性验证出来,发生反应的方程式是Fe+CuSO4=Cu+FeSO4.
分析 (1)①能电离出阳离子全部为氢离子的化合物为酸,根据紫色石蕊试液遇酸性溶液变红解答;
②根据在化合物中正负化合价代数和为零,进行解答;
(2)①铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水;
②在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
解答 解:(1)①盐酸和硫酸电离出的阳离子全部都为氢离子,H+ 都能使紫色石蕊溶液变红,所以紫色石蕊溶液变红的原因是因为它们溶液中都含H+,
故答案为:H+;
②根据在化合物中正负化合价代数和为零,K元素化合价为+1,氧元素的化合价为-2,可得KMnO4中锰元素的化合价为:(+1)+x+(-2)×4=0,解答 x=+7,即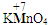 ,
,
故答案为:+7;
(2)①铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O,
故答案为:Fe2O3+6HCl═2FeCl3+3H2O;
②铁排在氢前面,铜和银都排在氢后面,因此利用金属与酸反应时,铜和银与酸都不反应,所以不能用金属与酸反应,可以利用金属与盐溶液的反应,可以将铁和银分别放入硫酸铜溶液中,铁能置换出铜,而银不能,化学方程为:Fe+CuSO4=Cu+FeSO4,
故答案为:Fe+CuSO4=Cu+FeSO4.
点评 本题考查了酸的通性、元素的化合价、除锈原理、利用金属活动顺序表设计实验,注意去验证金属的活动性强弱.氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来,题目难度中等.

练习册系列答案
相关题目
7.下列关于化学的认识说法不正确的是( )
| A. | 化学是在原子、分子水平上研究物质的组成和性质等 | |
| B. | 化学在能源和资源的合理利用等方面有着重要作用 | |
| C. | 化学是一门对人类生产和生活有着重要作用的实用学科 | |
| D. | 随着现代技术的发展,理论研究可以逐渐代替实验手段 |
13.下列关于强弱电解质的说法中,正确的是( )
| A. | Al2O3在熔化状态下全部电离,因而是弱电解质 | |
| B. | 具有极性键的共价化合物都是强电解质 | |
| C. | 具有非极性键的共价化合物都是弱电解质 | |
| D. | 所有弱酸、弱碱都是弱电解质 |
10.下列过程中,共价键被破坏的是( )
| A. | 晶体汞受热熔化 | B. | SiO2熔化 | C. | 冰融化成水 | D. | 酒精溶于水 |
17.(1)在下列物质中:
①CH≡C-CH2-CH3 ②C3H8 ③CH3-C≡C-CH2-CH3 ④1,3-戊二烯
⑤甲基环丁烷 ⑥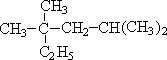 ⑦
⑦ ⑧
⑧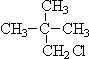
属于同系物的是①和③、②和⑥,
属于同种物质的是⑦⑧,
属于同分异构体的是③④.
(2)下列表中括号内的物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去,将所选的试剂及装置的编号填入表中,
试剂:a.水,b.氢氧化钠,c.食盐,d.溴水,e.生石灰,f.溴的四氯化碳溶液
分离装置:A.分液装置,B.过滤装置,C.蒸馏装置,D.洗气装置
①CH≡C-CH2-CH3 ②C3H8 ③CH3-C≡C-CH2-CH3 ④1,3-戊二烯
⑤甲基环丁烷 ⑥
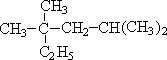 ⑦
⑦ ⑧
⑧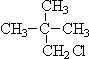
属于同系物的是①和③、②和⑥,
属于同种物质的是⑦⑧,
属于同分异构体的是③④.
(2)下列表中括号内的物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去,将所选的试剂及装置的编号填入表中,
试剂:a.水,b.氢氧化钠,c.食盐,d.溴水,e.生石灰,f.溴的四氯化碳溶液
分离装置:A.分液装置,B.过滤装置,C.蒸馏装置,D.洗气装置
| 需加入的试剂 | 分 离 装 置 | |
| 1-氯丙烷(乙醇) | ||
| 乙烷(乙烯) | ||
| 苯(苯酚) | ||
| 硬脂酸钠溶液(甘油) | ||
| 溴化钠溶液(碘化钠) |
7.下列是某化学小组为探究氢氧化钙的性质而进行的相关实验,请你也一起参与探究.
(1)小明通过一玻璃管向盛有澄清石灰水的试管中吹气,溶液变浑浊
(2)小丽向盛有澄清石灰水的试管中加入适量的碳酸钠溶液,溶液变浑浊.
(3)小倩向盛有少量氢氧化钙固体的试管中加入一定量的蒸馏水,液体变浑浊,再向其中加入3滴无色酚酞,液体变成红色,继续向试管中加入过量的稀盐酸,出现的现象是红色褪去,浑浊液体变澄清,据小倩同学的实验及现象可知氢氧化钙具有的性质有微溶于水、能使酚酞变红、能与(盐)酸反应.
(4)上述实验涉及的反应不属于碱的相似化学性质的反应方程式是Ca(OH)2+Na2CO3=CaCO3↓+2 NaOH,不属于基本反应类型的反应方程式是CO2+Ca(OH)2═CaCO3↓+H2O.
(5)实验后三位同学将试管中的废液倒入同一烧杯中,搅拌,得到无色溶液,则该溶液中一定含有的物质是NaCl、CaCl2、(酚酞)(或氯化钠、氯化钙(酚酞)).请设计实验证明可能存在的物质是否存在:
(1)小明通过一玻璃管向盛有澄清石灰水的试管中吹气,溶液变浑浊
(2)小丽向盛有澄清石灰水的试管中加入适量的碳酸钠溶液,溶液变浑浊.
(3)小倩向盛有少量氢氧化钙固体的试管中加入一定量的蒸馏水,液体变浑浊,再向其中加入3滴无色酚酞,液体变成红色,继续向试管中加入过量的稀盐酸,出现的现象是红色褪去,浑浊液体变澄清,据小倩同学的实验及现象可知氢氧化钙具有的性质有微溶于水、能使酚酞变红、能与(盐)酸反应.
(4)上述实验涉及的反应不属于碱的相似化学性质的反应方程式是Ca(OH)2+Na2CO3=CaCO3↓+2 NaOH,不属于基本反应类型的反应方程式是CO2+Ca(OH)2═CaCO3↓+H2O.
(5)实验后三位同学将试管中的废液倒入同一烧杯中,搅拌,得到无色溶液,则该溶液中一定含有的物质是NaCl、CaCl2、(酚酞)(或氯化钠、氯化钙(酚酞)).请设计实验证明可能存在的物质是否存在:
| 实验步骤 | 实验现象及结论 |
| 取实验所得的无色溶液少量于试管中,向试管中滴加石蕊溶液(或锌粒、碳酸钠等) | 溶液由无色变成红色(或有气泡冒出)说明溶液中还含有HCl |
11.在溶液中加入足量的Na2O2后仍能大量共存的离子组是( )
| A. | Na+、Fe2+、Cl-、SO42- | B. | K+、AlO2-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |