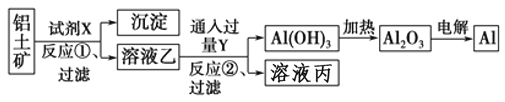
题目内容
【题目】Fe(OH)3 胶体和 MgCl2 溶液共同具有的性质是
A.都是无色透明的溶液
B.分散质粒子都可通过滤纸
C.加入盐酸后都无明显现象
D.都有丁达尔效应
【答案】B
【解析】
A.胶体不一定是无色透明的,如氢氧化铁胶体是红褐色透明的胶体,溶液都是透明的但不一定无色,如铜盐溶液是蓝色,故A错误;
B.溶液和胶体都能透过滤纸,故B正确;
C.胶体遇电解质溶液发生聚沉,盐酸能使Fe(OH)3沉淀溶解,溶液无此性质,故C错误;
D.只有胶体具有丁达尔效应,溶液不具备,故D错误;
故选B。

练习册系列答案
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目