题目内容
X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z位于同一周期,X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原予少1。下列说法不正确的是
| A.三种元素的非金属性由弱到强的顺序为Z<Y<X |
| B.Y元素的最高价氧化物对应水化物的化学式可表示为H2YO4 |
| C.3种元素的气态氧化物中.Z的气态氢化物最稳定 |
| D.原子半径由大到小排列顺序为Z>Y>X |
C
解析试题分析:由于最外层电子数不能超过8个,所以如果X原子的最外层电子数是其电子层数的3倍,则X一定是第二周期的氧元素。X、Y位于同一主族,且均是短周期元素,因此Y是S元素。Z原子的核外电子数比Y原予少1,元素Z是P元素。A、同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,因此三种元素的非金属性由弱到强的顺序为Z<Y<X,A正确;B、S元素是第ⅥA族元素,最高价是+6价,因此Y元素的最高价氧化物对应水化物的化学式可表示为H2YO4,B正确;C、非金属性越强,氢化物的稳定性越强,因此3种元素的气态氧化物中.X的气态氢化物最稳定,Z的氢化物最不稳定,C不正确;D、同周期自左向右原子半径逐渐减小,同主族自上而下 原子半径逐渐增大,因此原子半径由大到小排列顺序为Z>Y>X,D正确,答案选C。
考点:考查元素周期表的结构、核外电子排布以及元素周期律的应用

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
X、Y、Z、W为四种短周期元素,有关这四种元素的说法中一定正确的是
| 元素 | X | Y | Z | W |
| 原子半径(nm) | 0.077 | 0.075 | 0.102 | 0.099 |
| 最高正价或最低负价 | +4 | +5 | -2 | -1 |
A.Y的氢化物与W的氢化物反应的产物只含有共价键
B.1mol/L的单质参加氧化还原反应时转移的电子数为2mol
C.0.3molCu分别与足量HYO3和H2ZO4的稀溶液反应均产生0.2mol气体
D.X与Z形成XZ2时各原子均满足8电子稳定结构
X.Y两种元素形成含氧酸A和B,能说明酸A比酸B强的是
| A.酸A中X的化合价比酸B中Y化合价高 |
| B.酸A中X与酸B中Y在同一周期,且X在Y之后 |
| C.酸A与酸B的铵盐溶液反应生成酸B |
| D.酸A具有强氧化性,酸B没有强氧化性 |
下列叙述与对应图式正确的是
A.由下列短周期元素性质的数据推断③元素最高价氧化物对应的水化物碱性最强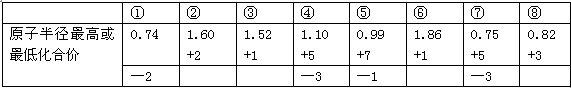 |
B.图甲表示Zn—Cu原电池反应过程中的电流强度的变化。T时可能加入了H2O2 |
| C.图乙表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变 |
| D.图丙表示元素周期表的一部分,元素X,Y,Z、W中X的氢化物酸性最强 |
下列说法不正确的是( )
| A.NH4+中质子数和电子数相等 |
| B.乙醇比乙二醇的沸点低 |
| C.乙炔与苯的实验式均为CH |
| D.过氧化钠与过氧化氢中均含有非极性键 |
下列说法正确的是
| A.第三周期元素的简单离子半径从左到右逐渐减小 |
| B.ⅦA族元素从上到下其氢化物的稳定性越来越强 |
| C.短周期元素形成离子后,最外层都能达到8(或2)电子稳定结构 |
| D.离子化合物中可能含有共价键,共价化合物中不可能含有离子键 |
短周期元素X、Y、Z、W、Q在周期表中的位置如图所示。下列说法不正确的是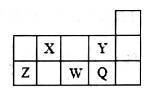
| A.元素的非金属性Y>Q,但其同浓度氢化物水溶液的酸性,HY<HQ |
| B.形成简单离子的半径从小到大的顺序是Y<Q<W |
| C.Z的最高价氧化物可溶于水,也能溶于强碱溶液 |
| D.X的气态氢化物浓溶液可用于检验管道氯气的泄漏 |
已知七种短周期元素a~g的有关信息如下表所示:
| 元素编号 | a | b | c | d | e | f | g |
| 原子半径 / nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -2 | +3 | +1 | +1 |
下列推断正确的是
A.简单离子的离子半径:g < e
B.氢化物的稳定性强弱:b > d
C.元素e的氧化物是两性氧化物
D.元素a与元素d形成的化合物属于离子化合物