题目内容
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
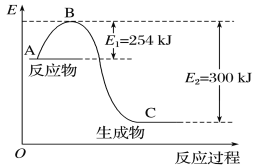
(1)如图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:___kJ·mol-1。
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
请回答下列问题:
ΔH3与ΔH1、ΔH2之间的关系是ΔH3=___。
(4)试比较下列两组△H的大小(填“>”、“<”或“=”)
①H2(g)+![]() O2(g)=H2O(g) △H1 H2(g)+
O2(g)=H2O(g) △H1 H2(g)+![]() O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2
则△H1____△H2
②S(s)+O2(g)=SO2(g) △H3
Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+10H2O(l)+2NH3(g) △H4
则△H3______△H4
【答案】N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1 390 2ΔH2-ΔH1 > <
2NH3(g) ΔH=-92 kJ·mol-1 390 2ΔH2-ΔH1 > <
【解析】
(1)反应热等于反应物与生成物能量差,且反应物的多少与热量变化相对应,据此书写热化学方程式;
(2)反应热等于反应物总键能与生成物总键能的差,据此计算;
(3)根据盖斯定律,将已知热化学方程式叠加,可得待求反应的热化学方程式;
(4)物质在气态时含有的能量比液态时含有的能量多;放热反应ΔH<0,吸热反应ΔH>0。
(1)由图可知:反应物能量比生成物能量高,反应发生放出热量,每发生反应产生1 mol氨气,放出热量Q=300 kJ-254 kJ=46 kJ,则该反应的热化学方程式可表示为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1;
2NH3(g) ΔH=-92 kJ·mol-1;
(2)N2与H2反应产生NH3,反应的热化学方程式可表示为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,由于反应热等于反应物总键能与生成物总键能的差,所以943 kJ/mol +3×435 kJ/mol -6×N-H kJ/mol =-92 kJ/mol,解得N-H的键能为:390 kJ/mol;
2NH3(g) ΔH=-92 kJ·mol-1,由于反应热等于反应物总键能与生成物总键能的差,所以943 kJ/mol +3×435 kJ/mol -6×N-H kJ/mol =-92 kJ/mol,解得N-H的键能为:390 kJ/mol;
(3)已知:反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
根据盖斯定律,将(II)×2-(I),整理可得(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3=2ΔH2-ΔH1;
(4)①由于反应物的能量相同,生成物的状态前者为气态,后者为液态,物质在气态时含有的能量比液态时含有的能量多,所以前者放出能量比后者少,反应放出热量越多,反应热就越小,△H1>△H2;
②S(s)+O2(g)=SO2(g)是放热反应,△H3<0,而反应Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+10H2O(l)+2NH3(g)是吸热反应,△H4>0,故两个反应的反应热:△H3<△H4。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】在不同条件下进行化学反应![]() ,B、D起始浓度均为0,反应物A的浓度
,B、D起始浓度均为0,反应物A的浓度![]() 随反应时间的变化情况如下表:下列说法不正确的是( )
随反应时间的变化情况如下表:下列说法不正确的是( )
序号 | 时间 温度 | 0 | 20 | 40 | 50 |
① | 800 |
|
|
|
|
② | 800 | x |
|
|
|
③ | 800 | y |
|
|
|
④ | 820 |
|
|
|
|
A.①中B在![]() min平均反应速率为
min平均反应速率为![]()
![]()
B.②中![]() ,可能使用了催化剂
,可能使用了催化剂
C.③中![]()
![]()
D.比较①④可知,该反应为吸热反应