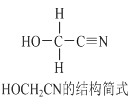
题目内容
【题目】下列说法正确的是( )
A.如图可表示水分解过程中的能量变化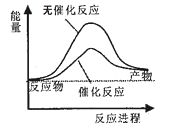
B.若2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知Ⅰ:反应H2(g)+Cl2(g)=2HCl(g) ΔH=-a kJ/mol,
Ⅱ:键能H-H:b kJ/mol,Cl-Cl:c kJ/mol。则断开1 mol H-Cl键所需能量为![]() kJ
kJ
【答案】A
【解析】
A.水分解反应是吸热反应,说明反应物的能量比生成物的能量低,且使用催化剂可以降低反应的活化能,但不影响反应热,A正确;
B.燃烧热是1mol可燃物完全燃烧产生稳定氧化物时放出的热量,C的稳定氧化物是CO2,不是CO,B错误;
C.任何反应发生都需要在一定条件下进行,与反应是放热反应还是吸热反应无关,如C的燃烧反应是放热反应,需在加热到一定温度下才能发生,C错误;
D.键能H-H:b kJ/mol,Cl-Cl:c kJ/mol。则断开1 mol H-Cl键所需能量为![]() kJ,D错误;
kJ,D错误;
故合理选项是A。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______。
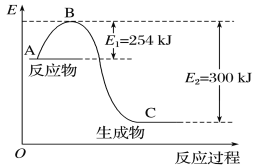
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:___kJ·mol-1。
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
请回答下列问题:
ΔH3与ΔH1、ΔH2之间的关系是ΔH3=___。
(4)试比较下列两组△H的大小(填“>”、“<”或“=”)
①H2(g)+![]() O2(g)=H2O(g) △H1 H2(g)+
O2(g)=H2O(g) △H1 H2(g)+![]() O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2
则△H1____△H2
②S(s)+O2(g)=SO2(g) △H3
Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+10H2O(l)+2NH3(g) △H4
则△H3______△H4