题目内容
【题目】下列说法正确的是( )
A.用惰性电极电解一定浓度的硫酸铜溶液,一段时间后,加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移电子数为0.4mol
B.磷酸的电离方程式为:H3PO4=H++H2PO4-
C.电镀时保持电流恒定,升温可知加快反应速率
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0
【答案】A
【解析】
![]() 惰性电极电解一定浓度的硫酸铜溶液,一段时间后,加入
惰性电极电解一定浓度的硫酸铜溶液,一段时间后,加入![]() 后恰好恢复到电解前的浓度和pH,说明该电解过程中相当于析出CuO和
后恰好恢复到电解前的浓度和pH,说明该电解过程中相当于析出CuO和![]() ,则阳极上只有氢氧根离子放电生成氧气,根据O元素和转移电子之间的关系式得转移电子的物质的量
,则阳极上只有氢氧根离子放电生成氧气,根据O元素和转移电子之间的关系式得转移电子的物质的量![]() ,故A正确;
,故A正确;
B.磷酸是中强酸,在水溶液中部分电离,电离方程式应该写“![]() ”,电离方程式为
”,电离方程式为![]() ,故B错误;
,故B错误;
C.电镀时保持电流恒定,即单位时间内转移的电子数恒定,则消耗的反应物与产生的生成物的量恒定,也就是反应速率恒定,与温度无关,故C错误;
D.如果![]() ,该反应能自发进行,该反应为熵减,则
,该反应能自发进行,该反应为熵减,则![]() ,要使
,要使![]() ,则该反应的
,则该反应的![]() ,故D错误;
,故D错误;
故答案选:A。

【题目】根据下列实验能得出相应结论的是
选项 | 实验 | 结论 |
A | 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/L Na2CO3溶液的pH | 酸性:HA>H2CO3 |
B | 向含有淀粉的FeI2溶液中加入足量溴水,溶液变蓝色 | 还原性:I->Fe2+ |
C | 向饱和FeSO4溶液中加入CuS固体,测得溶液中c(Fe2+)不变 | Ksp(CuS)<Ksp(FeS) |
D | 向氨水中滴加少量AgNO3溶液,无沉淀生成 | Ag+与NH3·H2O能大量共存 |
A. A B. B C. C D. D
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______。
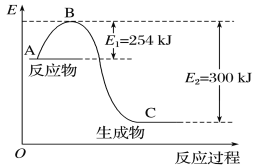
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:___kJ·mol-1。
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
请回答下列问题:
ΔH3与ΔH1、ΔH2之间的关系是ΔH3=___。
(4)试比较下列两组△H的大小(填“>”、“<”或“=”)
①H2(g)+![]() O2(g)=H2O(g) △H1 H2(g)+
O2(g)=H2O(g) △H1 H2(g)+![]() O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2
则△H1____△H2
②S(s)+O2(g)=SO2(g) △H3
Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+10H2O(l)+2NH3(g) △H4
则△H3______△H4