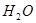题目内容
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。请回答下列问题:
(1)青铜的主要组成元素是铜元素和锡元素,请写出锡原子的价电子排布式 。
(2)向硫酸铜溶液里滴加氨水至过量,再加入乙醇,析出晶体,此物质中含有的化学键类型为 ,SO2—4的立体构型是 ,其中S原子的杂化轨道类型是 。
(3)N、O、F三种元素的电负性由大到小的顺序为 ,Cu2O的熔点高于Cu2S,请解释原因: 。
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的化学方应程式为 。
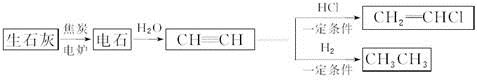
(5)用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g.cm-3,据此计算阿伏加德罗常数为 [列式并计算,结果用科学记数法表示,保留两位小数,己知Ar(Cu)=63.6]。
(1)5s25p2(2分)
(2)离子键、共价键、配位健(2分) 正四面体(1分) sp3杂化(1分)
(3)F>O>N(2分) Cu2O、Cu2S都是离子晶体,O2-半径比S2-半径小,阴阳离子的核间距小,晶格能大,熔点高(2分)
(4)Cu+H2O2+4NH3=[Cu(NH3)4](OH)2(2分)
(5)NA=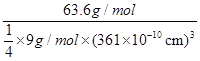 =6.01×1023mol-1(3分)
=6.01×1023mol-1(3分)
解析试题分析:(1)Sn位于元素周期表的第五周期第ⅣA族,所以根据构造原理可知,锡原子的价电子排布式是5s25p2。
(2)向硫酸铜溶液里滴加氨水至过量,再加入乙醇,析出晶体,该晶体是[Cu(NH3)4]SO4,属于配位化合物,含有的化学键是离子键、共价键、配位健。根据价层电子对互斥理论可知,SO2—4中S原子含有的孤对电子对数=(6+2-4×2)÷2=0,所以SO2—4的立体构型是正四面体,其中S原子的杂化轨道类型是sp3杂化。
(3)非金属性越强,电负性越大,所以N、O、F三种元素的电负性由大到小的顺序为F>O>N。由于Cu2O和Cu2S都是离子晶体,O2-半径比S2-半径小,阴阳离子的核间距小,晶格能大,所以Cu2O的熔点高于Cu2S。
(4)铜具有还原性,双氧水具有氧化性,而铜离子极易与氨气形成配位健,所以铜可与氨水和过氧化氢的混合溶液反应,反应的化学方应程式为Cu+H2O2+4NH3=[Cu(NH3)4](OH)2。
(5)晶胞为面心立方最密堆积,则晶胞中铜原子的个数是8×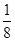 +6×
+6×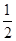 =4。晶胞的边长为361pm,铜的密度为9.00g.cm-3,则
=4。晶胞的边长为361pm,铜的密度为9.00g.cm-3,则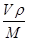 ×NA=4,因此阿伏加德罗常数为NA=
×NA=4,因此阿伏加德罗常数为NA=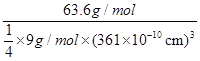 =6.01×1023mol-1。
=6.01×1023mol-1。
考点:考查核外电子排布、电负性比较、杂化轨道类型、分子空间构型、化学键、晶体熔点比较以及阿伏加德罗常数的有关计算

X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X原子的L层电子数是K层电子数的2倍 |
| Y | Y原子的最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的原子核 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X的活泼性比Y的 (填“强”或“弱”);X和Y的气态氢化物中,较稳定的是 (写化学式)。
(3)写出Z2Y2的电子式 ,XY2的结构式 。
(4)在X原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称 。氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式 。
一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。
(1)氯化钠的电子式是 。
(2)上述反应涉及的元素中,原子半径最大的是 。
(3)上述反应涉及的位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最价氧化物的水化物均能发生反应,该元素是 。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
| 时间(h) 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | 5.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 | 0.183 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 | 0.687 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 | 0.690 |
| 950℃ | 0.669 | 0.714 | 0.710 | 0.714 | 0.714 | ―― |
①分析数据可以得出,氯化钠熔浸钾长石是 (填“放热”或“吸热”)反应。
②950℃时,欲提高熔出钾的速率可以采取的措施是 (填序号)。
a.充分搅拌
b.延长反应时间
c.增大反应体系的压强
d.将钾长石粉粹成更小的颗粒
(5)该方法制得KCl提纯后可用来冶炼金属钾。反应Na(l)+KCl(l)
 NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。 下列是三个不同短周期部分元素的原子半径及主要化合价:
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.154 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 |
试回答下列问题:
(1)五种元素中原子半径最大的元素是 (填元素符号),画出该元素的原子结构示意图: 。
(2)W、X和Y可组成一化合物,其原子个数比为4:3:2,则该化合物属 (填“离子化合物”或“共价化合物”),存在的化学键是 。写出该化合物与由W、R和X按原子个数比为1:1:1组成化合物反应的化学方程式:
。
(3)写出下列反应的化学方程式:
Z的单质与Y元素的最高价氧化物对应的水化物反应: 。

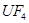 +
+ 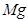 ——
——  +
+ 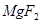
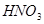 ——
—— 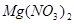 +
+ 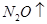 +
+