题目内容
5.过氧化钙为白色晶体,难溶于水,常用于种子消毒、药物制造、鱼池增氧等.Ⅰ.某实验小组在实验室用钙盐制取CaO2•8H2O.

(1)A为实验室制取氨气的装置,则A中试管所装的试剂的名称为氯化铵和氢氧化钙.
(2)仪器B的作用是防倒吸.
(3)写出生成CaO2•8H2O的化学方程式CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2•8H2O.
(4)制取CaO2•8H2O一般在低温下进行,原因是低于0℃,液体被冻结,反应困难,温度过高,过氧化氢分解速率加快,反应为放热反应,温度低有利于提高产率.
Ⅱ.该实验小组欲通过测量气体的体积来探究CaO2与SO2反应的特点,装置如图:(硬质玻璃管中为无水CaO2)

【提出假设】
假设1:只发生反应:2SO2+2CaO2=2CaSO3+O2,SO2未被氧化;
假设2:只发生反应:SO2+CaO2=CaSO4,SO2完全被氧化;
假设3:上述两个反应均发生,SO2部分被氧化.
【实验探究】
(5)该实验装置有一处明显错误,请用文字改正:装置E中广口瓶中的导气管应“短进长出”.
(6)试剂B为碱石灰,其作用是吸收未反应的SO2,防止装置E中的水蒸气进入硬质玻璃管与CaO2反应.
【实验数据处理】
实验测得装置C增重m g,装置E收集到的气体为V L(已换算成标准状况下).
(7)如果假设3成立,则V的取值范围是0<V<$\frac{7m}{30}$.
分析 (1)实验室制备氨气是利用固体氯化铵和氢氧化钙接加热反应生成;
(2)由于氨气在溶液中的溶解度比较大,且仪器B的上部能容纳较多的液体,因此其作用是防倒吸;
(3)结合题意和C装置中的反应物以及原子守恒可知,用CaCl2、H2O2、NH3可制得CaO2•8H2O;
(4)制取CaO2•8H2O一般在0~5℃的低温下进行,低于0℃,液体被冻结,反应困难,温度过高,过氧化氢分解速率加快,反应为放热反应;
(5)装置E量气装置导气管长进短处,不能排液体测定气体体积;
(6)试剂B的作用是吸收未反应的二氧化硫,防止对生成的氧气体积产生干扰.
(7)如果假设3成立,则二氧化硫部分被氧化,则生成部分氧气,结合反应2SO2+2CaO2=2CaSO3+O2和SO2+CaO2=CaSO4计算;
解答 解:(1)实验室中用氯化铵和氢氧化钙固体制取氨气,方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,所以A中试管所装的试剂的名称为氯化铵和氢氧化钙,
故答案为:氯化铵和氢氧化钙;
(2)根据B的特点构造可以知道B是长颈漏斗,该装置可以防倒吸,
故答案为:防倒吸;
(3)结合题意和C装置中的反应物以及原子守恒可知,用CaCl2、H2O2、NH3可制得CaO2•8H2O,反应方程式为CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2•8H2O,
故答案为:CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2•8H2O;
(4)制取CaO2•8H2O一般在0℃~5℃的低温下进行,低于0℃,液体被冻结,反应困难,温度过高,过氧化氢分解速率加快,反应为放热反应,低温有利于反应正向进行,
故答案为:低于0℃,液体被冻结,反应困难,温度过高,过氧化氢分解速率加快,反应为放热反应,温度低有利于提高产率;
(5)装置E量气装置导气管长进短处,不能排液体测定气体体积,装置E中广口瓶中的导气管应“短进长出”;
故答案为:装置E中广口瓶中的导气管应“短进长出”;
(6)装置E为测定生成气体的体积,需要把剩余的二氧化硫除去,所以试剂B的作用是吸收未反应的SO2,防止装置E中的水蒸气进入硬质玻璃管与CaO2反应,
故答案为:吸收未反应的SO2,防止装置E中的水蒸气进入硬质玻璃管与CaO2反应;
反应后的固体可能为Na2SO3或Na2SO4或二者的混合物,所以提出的假设有三种:
假设1:反应后固体只有Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设3:反应后固体为Na2SO3和Na2SO4的混合物,证明SO2部分被氧化;
如果二氧化硫完全被氧化,则反应产物为硫酸钙,二氧化硫全部被氧化,反应的化学方程式为:CaO2+SO2=CaSO4,
(7)如果假设3成立,则二氧化硫部分被氧化,则生成部分氧气,结合反应2SO2+2CaO2=2CaSO3+O2和SO2+CaO2=CaSO4可知,
若SO2未被氧化,发生反应方程式为:2CaO2+2SO2=2CaSO3+O2,依据化学方程式和反应增重计算E中收集的氧气:
2CaO2+2SO2=2CaSO3+O2 固体增重
1mol 96g
$\frac{V}{22.4}$mol mg
1mol×mg=96g×$\frac{V}{22.4}$mol,
解得:V=$\frac{7m}{30}$,
所以当二氧化硫部分被氧化时,则生成的氧气体积范围为:0<V<$\frac{7m}{30}$,
故答案为:0<V<$\frac{7m}{30}$.
点评 本题考查了性质实验方案的设计方法及有关范围讨论化学计算,题目难度中等,明确题干信息及实验目的为解答此类题的关键,解答过程中实验设计的步骤和实验方案的确定需要根据题干要求分析,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

| A. | 15g甲基(-CH3)所含有的电子数是10NA | |
| B. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$NA | |
| C. | 常温常压下,1mol丙烷所含有的共价键数目为11NA | |
| D. | 0.5mol 1,3一丁二烯分子中含有的碳碳双键数为NA |
(1)白醋溶液中存在的电离平衡为CH3COOH?CH3COO-+H+H2O?OH-+H+(用电离平衡方程式表示).
(2)常温下测定其中醋酸的电离程度(已电离的电解质分子数占原来总分子数的百分比).
设计实验方案,将待测物理量和对应的测定方法填写在下表中.
| 待测物理量 | 测定方法 |
| ①醋酸溶液的物质的量浓度 | 量取25.00ml醋酸溶液于锥形瓶中,滴加指示剂,将0.1000mol•L-1NaOH标准溶液装入碱式滴定管,滴定至终点,记录数据.重复滴定2次. |
| ②H+的物质的量浓度 | 取适量醋酸溶液于烧杯中,用pH计测定溶液pH |
[注:c平衡(CH3COOH)≈0.10mol/L,水的电离可忽略不计]
(4)现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
为了减小实验误差,该同学一共进行了3次滴定实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmo1/L,3次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
②该反应的平衡常数会随温度的降低而增大,(填“增大”“减小”或“无法确定”)理由是表格中起始投料表示反应总体向正反应方向进行,这会使气体的总物质的量减少,但气体的压强反而升高,说明该反应为放热反应,温度降低,平衡向正方向移动,平衡常数增大.
| A. | 铜丝与硝酸银溶液反应:Cu+Ag+=Cu2++Ag | |
| B. | 氧化铝与稀盐酸混合:Al2O3+6H+=2Al3++3H2O | |
| C. | 稀盐酸与氢氧化钠溶液混合:H++OH-=H2O | |
| D. | 氯气与氢氧化钠溶液反应:Cl2+2OH-=ClO-+Cl-+H2O |
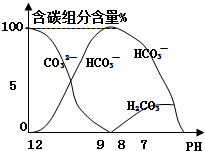 常温下在10mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液PH变化的部分情况如图所示.根据图示回答下列问题:
常温下在10mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液PH变化的部分情况如图所示.根据图示回答下列问题: