题目内容
16.A、B、C、D、E、F六种短周期元素的原子序数依次增大.A、C、F位于三个不同的周期,一定条件下可发生反应:A的单质+C的单质→气态化合物甲、A的单质+F的单质→气态化合物乙,且甲和乙相遇生成固体丙时有白烟产生;D元素原子最外层电子数是电子层数的3倍,B、D两元素原子的核外电子数之和等于C元素原子核内质子数的2倍;元素E是所在周期中简单离子半径最小的元素.按要求回答下列问题:(1)请在下列表格中用实线画出短周期主族元素的边界.
(3)化合物甲的结构式为
 ,物质丙的电子式为
,物质丙的电子式为 ;
;(4)元素B和D组成的化合物丁是绿色植物进行光合作用的主要原料之一,用电子式表示化合物丁的形成过程:
 ;
;(5)元素D的简单离子与元素E的简单离子的半径大小关系是O2->Al3+(用离子符号表示);
(6)B、C、F的最高价氧化物对应水化物的酸性有强到弱的顺序是HClO4>HNO3>H2CO3(用化学式表示);
(7)写出元素E的最高价氧化物与元素C的最高价氧化物对应水化物反应的离子方程式Al2O3+6H+=2Al3++3H2O.
分析 A、B、C、D、E、F六种短周期元素的原子序数依次增大.A、C、F位于三个不同的周期,一定条件下可发生反应:A的单质+C的单质→气态化合物甲、A的单质+F的单质→气态化合物乙,且甲和乙相遇生成固体丙时有白烟产生,应是氨气与HCl反应生成氯化铵,可推知A为H元素、C为N元素、F为Cl,甲为NH3、乙为HCl、丙为NH4Cl;D元素原子最外层电子数是电子层数的3倍,原子只能有2个电子层,最外层电子数为6,故D为O元素;元素E是所在周期中简单离子半径最小的元素,原子序数大于氧,只能处于第三周期,故E为Al;B、D两元素原子的核外电子数之和等于C元素原子核内质子数的2倍,则B原子核外电子数为7×2-8=6,故B为碳元素.(1)中第一、二、三为短周期,第一周期H、He两种元素,分别处于1、18列,第二、三周期分别有8种元素,分别处于1、2列及13~18列,且18列为零族元素,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素的原子序数依次增大.A、C、F位于三个不同的周期,一定条件下可发生反应:A的单质+C的单质→气态化合物甲、A的单质+F的单质→气态化合物乙,且甲和乙相遇生成固体丙时有白烟产生,应是氨气与HCl反应生成氯化铵,可推知A为H元素、C为N元素、F为Cl,甲为NH3、乙为HCl、丙为NH4Cl;D元素原子最外层电子数是电子层数的3倍,原子只能有2个电子层,最外层电子数为6,故D为O元素;元素E是所在周期中简单离子半径最小的元素,原子序数大于氧,只能处于第三周期,故E为Al;B、D两元素原子的核外电子数之和等于C元素原子核内质子数的2倍,则B原子核外电子数为7×2-8=6,故B为碳元素.
(1)第一、二、三为短周期,第一周期H、He两种元素,分别处于1、18列,第二、三周期分别有8种元素,分别处于1、2列及13~18列,且18列为零族元素,故短周期主族元素的边界为: ,
,
故答案为: ;
;
(2)元素F为Cl,在元素周期表中的位置为:第三周期第ⅦA族,
故答案为:第三周期第ⅦA族;
(3)化合物甲为NH3,结构式为 ,物质丙为NH4Cl,电子式为
,物质丙为NH4Cl,电子式为 ,
,
故答案为: ;
; ;
;
(4)元素B和D组成的化合物丁是绿色植物进行光合作用的主要原料之一,则丁为CO2,用电子式表示化合物CO2的形成过程: ,
,
故答案为: ;
;
(5)O2-、Al3+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Al3+,
故答案为:O2->Al3+;
(6)高氯酸是最强的酸,而硝酸为强弱,碳酸为弱酸,故酸性:HClO4>HNO3>H2CO3,
故答案为:HClO4>HNO3>H2CO3;
(7)元素E的最高价氧化物为Al2O3、元素C的最高价氧化物对应水化物为HNO3,二者反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O.
点评 本题考查位置结构性质关系应用及元素周期表,推断元素是解题关键,侧重考查学生对基础知识的掌握.

 阅读快车系列答案
阅读快车系列答案| A. | 分类回收、利用垃圾,减少资源浪费 | |
| B. | 推广使用一次性木筷,减少疾病传染 | |
| C. | 减少公车使用,从而减少化石燃料的使用 | |
| D. | 研究煤和石油脱硫技术,减少酸雨发生 |
| A. | NH3 | B. | SiCl4 | C. | BF3 | D. | PCl5 |
 与等物质的量的Br2发生加成反应,生成的产物是( )
与等物质的量的Br2发生加成反应,生成的产物是( )| A. | 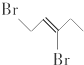 | B. | 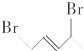 | C. |  | D. | 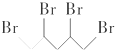 |
| A. | 8个中子的碳原子的核素符号:12C | B. | 氢氧化钠的电子式: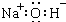 | ||
| C. | Cl-离子的结构示意图: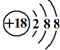 | D. | CH4分子的比例模型: |

 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:

 .
. .
.