��Ŀ����
����Ŀ��������ѧ֪ʶ��ա�
��1������������������Թ��ɣ������������������ᰴ��������������һ�飬������������ �� ������ű�ʾ��
��H3PO4 ��HClO ��H3BO3 ��HNO2
��2�����龧��ľ����ṹ��ɱ����ƣ�����һ��������ӽ������ڵļ������������
��3�����������Ӻ�δ�ɶԵ���Խ�࣬�����Խ�ż�¼����Խ�ã�������������V2O5��CrO2�У��ʺ���¼�����ŷ�ԭ�ϵ��� ��
��4��SiC��������ʯ�Ľṹ���ƣ�����Cԭ�Ӻ�Siԭ�ӵ�λ���ǽ���ģ���SiC����С�Ļ�������ԭ�ӣ�SiC����ʯ��ȣ��۵�ϸߣ�
ԭ���� ��
��5��������ľ����ṹ��ͼ����ԭ�ӵĿռ�������Ϊ �� ��֪�������ܶ���dg/cm3 �� �����ӵ�����ΪNA �� ����ԭ�ӵİ뾶��cm�� 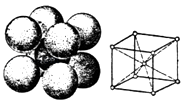
���𰸡�
��1���٣��ܣ��ڣ���
��2��12
��3��CrO2
��4��6�����ʯ�����߶���ԭ�Ӿ��壬C��C�����̣����ܴ����Խ��ʯ�۵����̼����
��5��68%��![]()
![]()
���������⣺��1.����H3PO4��д�ɣ�HO��3PO��n=1����HClO��д�ɣ�HO��1Cl��n=0����H3BO3��д�ɣ�HO��1B��n=0����HNO2��д�ɣ�HO��NO��n=1������H3PO4��HNO2���������HClO��H3BO3������������Դ��ǣ��٣��ܣ��ڣ��ۣ�
��2.�����龧���ṹ�����������ṹ����һ��������ӽ������ڵļ�����Ӹ���=3��8��2=12�����Դ��ǣ�12��
��3.��V2O5��V����������ȫ��ʧȥ��ɼ���CrO2��Crʧȥ4�����ӣ����ӵ���������Ϊ2��Ϊ�ɶԣ����Ӻ�δ�ɶԵ���Խ�࣬�����Խ�����ʺ���¼�����ŷ�ԭ�ϵ���CrO2 �� ���Դ��ǣ�CrO2��
��4.�����������С��Ϊ��Ԫ��������6��ԭ�ӣ�SiC��辧�����ƣ����Ҳ����6��ԭ�ӣ����߶���ԭ�Ӿ��壬�ṹ��������ƣ�Si��C��������C��C������C��Si����С�����Խ��ʯ������۷е����̼���裬���Դ��ǣ�6�����ʯ�����߶���ԭ�Ӿ��壬C��C�����̣����ܴ����Խ��ʯ�۵����̼���裻
��5.����������λ�ھ����Ķ�������ģ�����ƽ������8�� ![]() +1=2����ԭ�ӣ��辧���߳�Ϊx������ԭ�Ӱ뾶Ϊ
+1=2����ԭ�ӣ��辧���߳�Ϊx������ԭ�Ӱ뾶Ϊ ![]() x����ռ�������Ϊ
x����ռ�������Ϊ ![]() ��100%=
��100%= ![]() ��100%=68%�����������ܶ�Ϊdgcm��3 �� �������ԭ��������56������d=
��100%=68%�����������ܶ�Ϊdgcm��3 �� �������ԭ��������56������d= ![]() ��x=
��x= ![]() cm��������ԭ��Ϊ
cm��������ԭ��Ϊ ![]()
![]() cm�����Դ��ǣ�68%��
cm�����Դ��ǣ�68%�� ![]()
![]() ��
��