题目内容
【题目】氮、砷(As)均为第ⅤA族元素。回答下列问题:
(1)元素周期表中,As位于第_____周期,基态As的价电子排布式为______。与As同周期,基态原子的核外电子排布式中有5个未成对电子的元素是______(写元素符号)。
(2)隔夜的叶菜类熟菜不能食用,原因是其中的部分![]() 在硝酸还原酶作用下转化为致癌的
在硝酸还原酶作用下转化为致癌的![]() 。
。![]() 中N原子的杂化方式为__________________,
中N原子的杂化方式为__________________,![]() 的空间构型是______。
的空间构型是______。
(3)氢氰酸(HCN)可用于制造剧毒的氢氰酸盐毒药,氢氰酸分子的结构式为__________________。
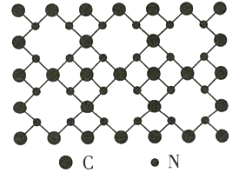
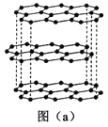
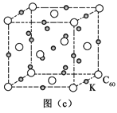
(4)立方氮化硼(BN)质地非常坚硬,是超硬材料,可制成高速切割工具和地质勘探、石油钻探的钻头,其晶胞结构如图所示(黑球为B原子):
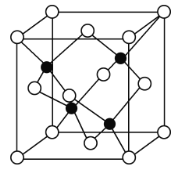
BN晶体中N原子的配位数是______。若阿伏加德罗常数的值为NA,该晶体的密度为ρ g.cm-3,则晶胞边长a=______nm(用含ρ和NA的最简式表示)。
【答案】四 4s24p3 Mn sp2 V形或角形 ![]() 4
4 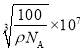
【解析】
(1)根据周期表的结构以及原子的核外电子排布分析解答;
(2)根据价层电子对互斥理论以及杂化轨道理论分析解答;
(4)根据晶胞结构计算分析。
(1)As位于元素周期表第四周期第ⅤA族,第ⅤA族元素的价电子排布通式为ns2np3,因As位于第四周期,故其价电子排布式为4s24p3;与As同周期,即第四周期,基态原子的核外电子排布式中有5个未成对电子的元素是Mn;
(2)![]() 中N原子的σ键电子对数为3,孤电子对数为
中N原子的σ键电子对数为3,孤电子对数为![]() ,则价电子对数为3,故
,则价电子对数为3,故![]() 中N原子的杂化方式为sp2,
中N原子的杂化方式为sp2,![]() 中N原子的σ键电子对数为2,孤电子对数为
中N原子的σ键电子对数为2,孤电子对数为![]() ,价电子对数为3,故
,价电子对数为3,故![]() 的空间构型是V形或角形;
的空间构型是V形或角形;
(3)氢氰酸(HCN)属于共价化合物,根据氢成1键,碳成4键,氮成三键规律,该分子的结构式为![]() ;
;
(4)由BN的晶胞可知,B原子的配位数为4,因晶胞中二者原子数之比为1∶1,则N原子的配位数也是4;由晶胞结构可知,每个晶胞中含4个N和4个B,则1个晶胞的质量![]() ,体积
,体积![]() ,则
,则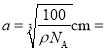
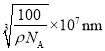 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
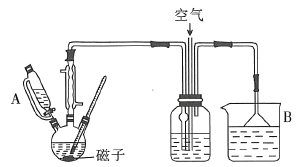
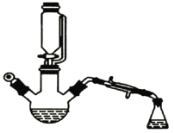
小学生10分钟应用题系列答案【题目】用下图所示装置制备乙酸乙酯粗产品(加热和夹持装置等省略),有关数据如下表所示:
物质 | C2H5OH | CH3COOH | CH3COOC2H5 |
密度g/cm3 | 0.79 | 1.05 | 0.90 |
沸点/℃ | 78.3 | 118 | 77.1 |
已知:乙醇可以和氯化钙反应生成微溶于水的CaC12·6C2H5OH。在三颈烧瓶内将过量的乙醇和少量的浓硫酸混合,然后经恒压分液斗边滴加酸,边加热蒸馏。得到含有乙醇、醋酸和水的乙酸乙酯粗产品。
(1)混合乙醇与浓硫酸时,应先加入的试剂是_______;浓硫酸的作用是__________。
(2)边滴加醋酸,边加热蒸馏的目的是_______。将粗产品再经下列步骤精制:
(3)为除去其中的醋酸,可向粗产品中加入______(填序号)。
A.无水乙醇 B.碳酸钠粉末 C.无水醋酸钠
(4)向其中加入饱和氯化钙溶液。振荡、分离。其目的是______。
(5)然后再向其中加入无水硫酸钠,振荡,静置,以除去水分。最后,将经过上述处理后的液体放入一干燥的蒸馏烧瓶内。再蒸馏,弃去低沸点馏分,收集沸程76℃~____℃(填“78”或“118“)之间的馏分即得纯净的乙酸乙酯。
(6)在实验中原料用量:23.0mL乙醇、15.0mL冰醋酸,最终得到16.0mL乙酸乙酯,则本次实验中乙酸乙酯的产率为________(百分数精确到0.1)。