题目内容
【题目】某化学兴趣小组在实验室探究氨的有关性质,设计了下图所示实验,A处是气体发生装置,A中所用的实验药品从下列物质中选取。①碳酸钠 ②碳酸氢钠 ③碳酸氢铵 ④氯化铵 ⑤熟石灰 ⑥氢氧化钠

按上图连接好各仪器,先将C处的铂丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯,部分实验的现象如下:铂丝继续保持红热状态,D中的铜片慢慢溶解。回答下列问题:
(1)若A中制取气体时只用了一种药品,则该药品是___________(填物质序号)。
(2)B装置的作用为________________________;
(3)C中发生反应的方程式为________________________;
(4)图E中持续通入氧气的作用为_______________________;
(5)有人认为他们设计的这套实验装置还存在明显的不足,对其不足之处以及应如何改进,谈谈你的意见:______________。
(6)已知NH3难溶于CCl4,则下列装置中,不能用于吸收氨气的是(_____)

【答案】 ③ 吸收二氧化碳和水蒸气并产生氧气  使有害气体吸收更完全 D装置的液体易倒流入玻璃管C中,使玻璃管破裂,可在C装置与D装置之间连接一防倒吸装置 B
使有害气体吸收更完全 D装置的液体易倒流入玻璃管C中,使玻璃管破裂,可在C装置与D装置之间连接一防倒吸装置 B
【解析】本实验探究的是氨气的还原性。该实验可以加热碳酸氢铵制氨气,也可以加热氯化铵和熟石灰的混合物制氨气。制得的氨气经过盛有过氧化钠的U形管时其中的杂质与过氧化钠反应生成氧气,氨气和氧气一起通入C装置遇热的铂丝催化后,氨气被氧气氧化为NO,此反应为放热反应,所以铂丝可保持红热。NO再与氧气反应生成NO2,将NO2通入水中与水反应生成了硝酸,硝酸把铜溶解生成硝酸铜和NO。E和F为尾气处理装置,NO不能单独被氢氧化钠溶液吸收,所以又从E充入了氧气,以保证尾气中NO被充分吸收。
(1)若A中制取气体时只用了一种药品,则该药品是③碳酸氢铵。
(2)B装置的作用为吸收二氧化碳和水蒸气并产生氧气;
(3)C中发生反应的方程式为 ;
;
(4)图E中持续通入氧气的作用为使有害气体吸收更完全;
(5) D装置的液体易倒流入玻璃管C中,使玻璃管破裂,可在C装置与D装置之间连接一防倒吸装置(比如连接一个空的广口瓶作为安全瓶,一旦发生倒吸,液体进入安全瓶,不会直接进入C装置中)。
(6)氨气极易溶于水,直接将氨气通入水中易发生倒吸,A、C、D三个装置都有了防倒吸的措施而B没有,所以不能用于吸收氨气的是B。

【题目】工业上常用二氧化硫来漂白纸浆、丝毛、草帽等,此外二氧化硫还能够抑制霉菌和细菌的滋生,可以用作食物和干果的防腐剂。但必须严格按照国家有关范围和标准使用,我国规定葡萄酒中SO2的最大使用量为0.25g/L。某化学兴趣小组制备并对SO2的化学性质和用途进行探究,探究过程实验装置如下图,夹持仪器省略。
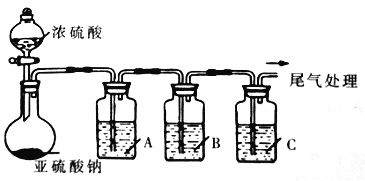
(1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等。
①请完成下列表格
试剂 | 作用 | |
A | _______ | 验证SO2的还原性 |
B | Na2S溶液 | ___ |
C | 品红溶液 | ___ |
②A中发生反应的离子方程式为_______________________。
③在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验:
方案一:往第一份试液中加入少量酸化的KMnO4溶液,紫红色褪去。该方案是否合理________。(填“是”或“否”)
方案二:往第二份试液中加入K3[Fe(CN)6]溶液,实验现象为____________。
④该小组将SO2通入酸化的高锰酸钾溶液中,再向溶液中滴加氯化钡溶液,发现有白色沉淀生成,说明SO2具有还原性。该方案的不妥之处可能为_____________。
(2)该兴趣小组利用“直接碘量法”对葡萄酒中的SO2进行测量。取50.00ml葡萄酒样品于250ml碘量瓶中。加入少量碎冰块,再加入1ml淀粉指示液,10ml硫酸溶液,用浓度为cmol/L的碘标准滴定溶液迅速滴定至淡蓝色,保持30s不变即为终点,记下消耗碘标准滴定溶液的体积为Vml。以水代替样品,做空白试验,操作同上,空白试验消耗碘标准滴定溶液的体积为Voml。该葡萄酒中SO2含量计算式为___g/L。
【题目】80℃时,NO2(g)+SO2(g)![]() SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol L-1 | 0.10 | 0.20 | 0.20 |
C(SO2)/ mol L-1 | 0.10 | 0.10 | 0.20 |
A. 容器甲中的反应在前2 min的平均速率v(SO2)=0.05 mol L-1 min-1
B. 达到平衡时,容器丙中正反应速率与容器甲相等
C. 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0
D. 容器乙中若起始时改充0.10 molL-1 NO2和0.20molL-1 SO2,达到平衡时c(NO)与原平衡相同

