��Ŀ����
����Ŀ��������ѧ֪ʶ���������Ŀ��
��1��X��̬ԭ�ӵ�M����K���������ȣ���X���������е�һ����������Ԫ���� ��
��2����Y2+���ӵ�3d�������9�����ӣ���̬Yԭ�ӵļ۵����Ų�ʽΪ
�ڽ�Y��ĩ����NH3��Ũ��Һ�У�ͨ��O2 �� ��ַ�Ӧ����Һ������ɫ���������·�Ӧ��
2Y+8NH3H2O+O2=2[Y��NH3��4]��OH��2+6H2O���ù������γɵĻ�ѧ��������
a������ b���Ӽ� c���Լ� d�Ǽ��Լ� e��λ�� f��� g���»���
��3��K2Cr2O7��һ�ֳ�����ǿ�����������������»ᱻ��ԭ����ԭ��Cr3+ �� Cr3+����OH����CN���γ������[Cr��OH��4]����[Cr��CN��6]3�� ��
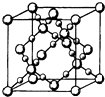
�ٲ����ǿռ乹�ͣ�[Cr��OH��4]���Ľṹ����ʾ��ͼ��ʾΪ��������λ�����ü��ű�ʾ��
��һ��������������LaCrO3�ľ�����ͼ1��ʾ����֪����ÿ��Crԭ�������Oԭ����6������ͼ��ԭ�Ӵ�������Crԭ�ӣ���A��B��C����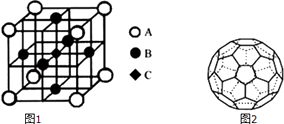
��4��̼��һ�ֵ��ʽṹ��ͼ2��ʾ������Է�������Ϊ720�����ӹ���Ϊһ��32���壬������12����Ԫ����20����Ԫ������õ�����̼ԭ�ӵ��ӻ���ʽ�� �� 1mol�õ����д��ڵĦм���ĿΪ ��
���𰸡�
��1��Ar
��2��3d104s1��ce
��3��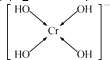 ��C
��C
��4��sp2��30NA
���������⣺��1��X��̬ԭ�ӵ�M����K���������ȣ���M��K�����2�����ӣ�XΪMgԪ�أ��ڵ������ڣ�ͬ������ϡ������ĵ�һ�����������������ڵ�һ������������Ar��
���Դ��ǣ�Ar����2����Y2+���ӵ�3d�������9�����ӣ�Yԭ�Ӻ��������=2+8+8+9+2=29����RΪCuԪ�أ�������Ų�ʽΪ1s22s22p63s23p63d104s1 �� ��Cu�ļ۵����Ų�ʽΪ��3d104s1��
���Դ��ǣ�3d104s1��
��2Cu+8NH3H2O+O2=2[Cu��NH3��4]��OH��2+6H2O��Ӧ�����������γ���λ����ͬʱ���м��Թ��ۼ����ɣ�
���Դ��ǣ�ce����3����[Cr��OH��4]2���е�Cr2+��4��OH���γ���λ�����ɱ�ʾΪ  ��
��
���Դ��ǣ�  ��
��
�ڸþ�����Bԭ�Ӹ���=6�� ![]() =3��Aԭ�Ӹ���=8��
=3��Aԭ�Ӹ���=8�� ![]() ��Cԭ�Ӹ�����1���Ҿ���ÿ��Crԭ�������ԭ����6������c������ԭ�ӣ����Դ��ǣ�C����4��A��ÿ��̼��Χ��һ��̼̼˫��������̼̼��������Cԭ�ӵļ۲���Ӷ���Ϊ3����������sp2�ӻ���A��һ�ֵ�����Է�������Ϊ720����÷���ΪC60 �� ���ӹ���Ϊһ��32���壬������12����Ԫ����20����Ԫ����ÿ��̼��Χ��һ��̼̼˫��������̼̼��������Ϊ����̼���ã�����ÿ��̼ʵ��ռ�е�̼̼˫����Ϊ0.5����ÿ��˫������һ���м�������C60�Цм�����ĿΪ60��0.5NA=30NA ��
��Cԭ�Ӹ�����1���Ҿ���ÿ��Crԭ�������ԭ����6������c������ԭ�ӣ����Դ��ǣ�C����4��A��ÿ��̼��Χ��һ��̼̼˫��������̼̼��������Cԭ�ӵļ۲���Ӷ���Ϊ3����������sp2�ӻ���A��һ�ֵ�����Է�������Ϊ720����÷���ΪC60 �� ���ӹ���Ϊһ��32���壬������12����Ԫ����20����Ԫ����ÿ��̼��Χ��һ��̼̼˫��������̼̼��������Ϊ����̼���ã�����ÿ��̼ʵ��ռ�е�̼̼˫����Ϊ0.5����ÿ��˫������һ���м�������C60�Цм�����ĿΪ60��0.5NA=30NA ��
���Դ��ǣ�sp2��30NA ��

����Ŀ����2L���ܱ������н������·�Ӧ��CO��g��+H2O��g��CO2��g��+H2��g�������������ݣ�
ʵ�� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | |||
CO | H2O | CO2 | H2 | CO2 | ||
1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
����˵����ȷ���ǣ� ��
A.����ӦΪ���ȷ�Ӧ
B.ʵ��1�У�CO��ת����Ϊ80%
C.650��ʱ����ѧƽ�ⳣ��K= ![]()
D.ʵ��1�ټ���1.0 mol H2O�����´ﵽƽ��ʱ��n��CO2��Ϊ1.6 mol
����Ŀ��A��B��C��D�������ʾ�Ϊ����������ɵĿ����Ի����������������ʵ����ӣ����Ӳ����ظ���ϣ��У�
������ | Na+��Al3+��Ba2+��NH4+ |
������ | Cl����OH����CO32����SO42�� |
�ֱ�ȡ�������ʽ���ʵ�飬ʵ��������
��B��Һ�ֱ���C��D��ϣ����а�ɫ�������ɣ�
�ڽ�A��Һ��ε���C��Һ�У��г������ɣ������μ�A��Һʱ����������ֱ����ȫ��ʧ��
��A��D���ֹ����ϼ������������ɣ���������ʹʪ��ĺ�ɫʯ����Һ������
����ʯī�缫���B��Һ���������ϲ���һ���д̼�����ζ�����壮
��1��A�����������ӵĵ���ʽ�� �� B�������������� ��
��2��C�Ļ�ѧʽ�� �� D�Ļ�ѧʽ�� ��
��3��д�����г����ܽ�����ӷ���ʽ ��