��Ŀ����
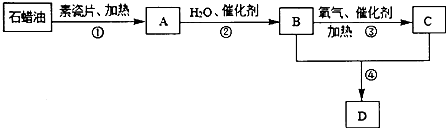
����Ŀ���ۺ�������[Fe2��OH��n��SO4��3��n/2]m��һ������Ч��ˮ������������ij����С��������·����Ʊ��ۺ��������������������ͼ1��
Ϊ�ⶨ��Һ������Ԫ�ص��ܺ�����ʵ��������£�ȷ��ȡ20.00mL��Һ���ڴ�����ƿ�У���������H2O2 �� ����pH��3��������У��������KI��ַ�Ӧ������0.1 000molL��1 Na2S2O3����Һ�ζ����յ㣬���ı���ҺVXmL����֪��I2+2S2O32���TI��+S4O62�� �� ��
��1��ʵ������м�����е�Ŀ���� ��
��2���ڲⶨ�����м�������H2O2������Ӧ���ӷ���ʽ�� ��
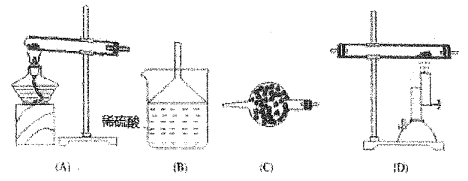
��3���ζ�������ѡ��װ����Һ��������ͼ2���Ƿ��������ǡ���
��4��д���ζ�ѡ�õ�ָʾ�� �� �ζ��յ�۲쵽������ ��
��5������ͼ1���ĵ�Na2S2O3����Һ������������Һ������Ԫ�ص��ܺ���ΪgL��1 �� ���ζ�ǰ��Һ��H2O2û�г��������ⶨ����Ԫ�صĺ����������ƫ�ߡ���ƫ�͡����䡱����
��6��������������Һ������Ԫ�ش��ڲ�ͬ�����ӣ������������������貢���ʵ�鷽��֤���������1����Һ����ֻ����Fe2+ ����2����Һ����ֻ����Fe3+ ����3�� ��
�����ṩ�Լ���ʵ����Ʒ��֤����3����
��ѡʵ���Լ���1.0molL��1 NaOH��Һ��8.0molL��1 NaOH��Һ��0.01molL��1KMnO4�����۩�KI��Һ��3moLL��1H2SO4����ɫʯ����Һ��0.1molL��1 K3[Fe��CN��6]��Һ���Թܡ���ͷ�ι�
ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡ������Һ�����Թ�A��B�� | |
����2�� | |
����3�� |
���𰸡�
��1����ȥ������H2O2 �� ��ֹӰ��ⶨ
��2��2H++H2O2+2Fe2+=2Fe3++2H2O
��3����
��4�����ۣ���Һ����ɫ����ɫ�ұ��ְ���Ӳ���ɫ
��5��5.6��ƫ��
��6����Һ���д���Fe2+��Fe3+
ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡ������Һ�����Թ�A��B�� | �� |
����2�� | ���Թ�A�е���2��3�ε��۩�KI��Һ�����۲�仯����Һ����ɫ��֤����Һ���к���Fe3+�� |
����3�� | ���Թ�B����3moL?L��1H2SO4�ữ���ٵ���2��3��KMnO4��Һ�����۲�仯�� |
���������⣺��1������˫��ˮ���������ԣ��ܹ�����Na2S2O3 �� Ӱ��ⵥ�ʵIJⶨ��˫��ˮ���ȶ������Ⱥ��ܹ���ȥ�����Լ�����е�Ŀ���dz�ȥ������H2O2 �� ��ֹӰ��ⶨ�����Դ��ǣ���ȥ������H2O2 �� ��ֹӰ��ⶨ����2��˫��ˮ���������ӷ�Ӧ�����ӷ���ʽΪ��2H++H2O2+2Fe2+=2Fe3++2H2O��
���Դ��ǣ�2H++H2O2+2Fe2+=2Fe3++2H2O�� ��3��Na2S2O3��Һ��ʾ���ԣ�Ӧ��ʹ�ü�ʽ�ζ���ʢ�ţ�ͼʾ�ζ���Ϊ��ʽ�ζ��ܣ����Բ�������
���Դ��ǣ���4�����ڵⵥ������������ʾ��ɫ���ʿ�ѡ�õ���Ϊ�ζ�ָʾ�����ζ�����ǰ��ҺΪ��ɫ���ζ�����ʱΪ��ɫ����ζ��յ������Ϊ����Һ����ɫ����ɫ�ұ��ְ���Ӳ���ɫ��
���Դ��ǣ����ۣ���Һ����ɫ����ɫ�ұ��ְ���Ӳ���ɫ���� ��5��ͼ2�г�����Ϊ0.20mL��ĩ����Ϊ20.20mL����ζ�����������Na2S2O3��Һ�����Ϊ��20.20mL��0.20mL=20.00mL��������������Ƶ����ʵ���Ϊ��0.1 000molL��1��0.02L=0.002mol��
���ݵ����غ㼰��Ӧ2H++H2O2+2Fe2+=2Fe3++2H2O��I2+2S2O32���TI��+S4O62���ɵù�ϵʽ��2Fe2+��2Fe3+��I2��2S2O32�� �� ��20.00mL��Һ���к����������ӵ����ʵ���Ϊ��n��Fe2+��=n��S2O32����=0.002mol��
������Һ������Ԫ�ص��ܺ���Ϊ�� ![]() =5.6g/L��
=5.6g/L��
���ζ�ǰ��Һ��H2O2û�г�����˫��ˮ�ܹ�������������ƣ���ⶨ�ĵⵥ�ʵ����ʵ���ƫ�����ⶨ����Ԫ�صĺ�������ƫ�ߣ�
���Դ��ǣ�5.6��ƫ�ߣ���6�����ݼ���1����Һ����ֻ����Fe2+������2����Һ����ֻ����Fe3+��֪����Һ�п���ͬʱ���������Ӻ��������ӣ��ʼ���3Ϊ����Һ���д���Fe2+��Fe3+��
��֤����3��������Ҫ�ֱ����Fe2+��Fe3+ͬʱ���ڣ�������������Ͳ���Ϊ��ȡ������Һ�����Թ�A��B�У����Թ�A�е���2��3�ε��۩�KI��Һ������Һ����ɫ��֤����Һ���к���Fe3+�����Թ�B����3moLL��1H2SO4�ữ���ٵ���2��3��KMnO4��Һ��������Һ��ɫ������ɫ��ɻ�ɫ���dz������Fe2+����������軯����Һ������ɫ�������ɣ�����Fe2+����ϲ���2��֪����3������
���Դ��ǣ���Һ���д���Fe2+��Fe3+��
ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡ������Һ�����Թ�A��B�� | �� |
����2�� | ���Թ�A�е���2��3�ε��۩�KI��Һ�����۲�仯����Һ����ɫ��֤����Һ���к���Fe3+�� |
����3�� | ���Թ�B����3moLL��1H2SO4�ữ���ٵ���2��3��KMnO4��Һ�����۲�仯�� |