题目内容
【题目】属于放热反应的是
A.氢气还原氧化铜B.氨气的分解C.氢气在氧气中燃烧D.碳酸钙高温分解
【答案】C
【解析】
A. 氢气高温与金属氧化物发生的置换反应都是吸热反应,氢气还原氧化铜属于吸热反应,A项错误;
B. 大多数分解反应是吸热反应,氨气分解的反应属于吸热反应,B项错误;
C. 燃烧反应都是放热反应,C项正确;
D. 碳酸钙高温分解属于吸热反应,D项错误;
答案选C。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】U、V、W、Y、Z是原子序数依次增大的短周期主族元素,U、Y在周期表中的相对位置如图1;U元素与氧元素能形成两种无色气体;W是地壳中含量最多的金属元素.
(1)元素Z在周期表中位于第族.我国首创以W组成的金属﹣海水﹣空气电池作为能源的新型海水标志灯,它以海水为电解质溶液,靠空气中的氧气使W组成的金属不断氧化而产生电流.只要把灯放入海水中数分钟,就会发出耀眼的白光.则该电源负极反应为 .
(2)YO2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VO,有关反应的离子方程式为 , 由此可知YO2和VO还原性较强的是(写化学式) .
(3)V的最简单气态氢化物甲的水溶液显碱性.①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为 .
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变如表中反应条件x,该平衡体系中随x递增y递增的是(选填序号).
选项 | a | b | c | d |
x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
③向含4molV 的最高价含氧酸的稀溶液中,逐渐加入Fe粉至过量.假设生成的气体只有一种,请在图2坐标系中画出n(Fe2+)随n(Fe)变化的示意图 .
(4)相同温度下,等体积、物质的量浓度都为0.1mol/L的KZ和CH3COOK溶液的两种溶液中,离子总数相比较 .
A.前者多
B.一样多
C.后者多
D.无法判断.
【题目】单晶硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450﹣500℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.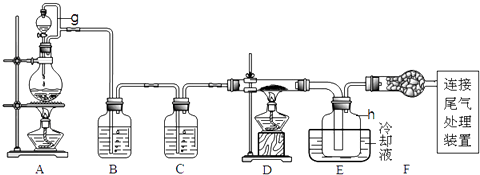
查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | ﹣ | 315 | ﹣ |
熔点/℃ | ﹣70.0 | ﹣ | ﹣ | ﹣ |
升华温度/℃ | ﹣ | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 .
(2)装置A中g管的作用是;装置C中的试剂是;装置E中的h瓶需要冷却理由是 .
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质.为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+ , 再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+ . ①写出用KMnO4滴定Fe2+的离子方程式:;
②滴定前是否要滴加指示剂?(填“是”或“否”),判断滴定终点的方法是 .
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10﹣2molL﹣1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 . 若滴定前平视,滴定后俯视KMnO4液面,对测定结果有何影响(填“偏高”、“偏低”、或“无影响”)