题目内容
【题目】Ⅰ、氨气有广泛用途,工业上利用反应N2(g)+3H2 (g) ![]() 2NH3(g) H<0合成氨,回答以下问题:
2NH3(g) H<0合成氨,回答以下问题:
(1)某小组为了探究外界条件对反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
①有同学认为由条件a到b可能是加了催化剂。这种分析正确吗?理由是______。
②在a条件下t1时刻将容器体积压缩至原来的1/2,t2时刻重新建立平衡状态。请在答题卡相应位置画出t1时刻后c(H2)的变化曲线并作相应的标注______。

(2)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图B为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
① 比较T1、T3的大小T1____T3(填“<”或“>”)。
②分析体系在T2、60MPa下达到的平衡,此时H2的平衡分压为____MPa(分压=总压×物质的量分数)。
Ⅱ.工业上常用反应2NO2(g) ![]() N2(g)+2O2(g),△H=QkJ/mol实现绿色环保、废物利用。设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。
N2(g)+2O2(g),△H=QkJ/mol实现绿色环保、废物利用。设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。

则
①Q_____0(填“> ”、“= ”或“< ").
②下列关于该反应说法不正确的是____
A.在恒温恒容的条件下,容器内气体颜色不变,说明该反应达到反应限度
B.如将该反应条件降低由恒温恒容改为恒温恒压,O2的百分含量将减小
C.在恒温恒容时,向平衡体系通入NO2,平衡正向移动,但NO2转化率将降低
D.增大压强,平衡逆向移动,说明逆反应速率增大,正反应速率减小。
③A点时,设容器的总压为a Pa,则其平衡常数Kp为____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。B点时,NO2的转化率为____。
Ⅲ. N2O5(g)的分解存在两个平衡:①N2O5(g) ![]() N2O3(g)+O2(g); ②N2O3(g) N2O(g)+O2(g)T0C时,在一个2L的固定容积的密闭容器中,充入2 mol N2O5,平衡时测得N2O的浓度为0.25 mol/L,O2的浓度为0.75mol/L,则N2O的物质的量为__ mol,此时反应①的平衡常数为____ 。
N2O3(g)+O2(g); ②N2O3(g) N2O(g)+O2(g)T0C时,在一个2L的固定容积的密闭容器中,充入2 mol N2O5,平衡时测得N2O的浓度为0.25 mol/L,O2的浓度为0.75mol/L,则N2O的物质的量为__ mol,此时反应①的平衡常数为____ 。
【答案】错误,催化剂只能加快反应速率,不能改变平衡 <15>BDa/566.7%(或2/3)0.50.375
<15>BDa/566.7%(或2/3)0.50.375
【解析】
Ⅰ、(1)①从图像可知,在a、b两种条件下达到的平衡不同,不可能是使用催化剂,催化剂只能加快反应速率,不能改变平衡;
因此,本题正确答案是:错误,催化剂只能加快反应速率,不能改变平衡;
②体积缩小1/2,氢气的浓度会从c1突增到2 c1,然后根据缩小体积、增大压强,平衡右移,氢气的浓度减少但始终在c1与2 c1之间,画出t1时刻后c(H2)的变化曲线为: ;
;
因此,本题正确答案是:  。
。
(2)①该反应为放热反应,当压强不变的情况下,降低温度,平衡右移,氨气的体积分数增大,从图像看出,T1小于T3;
因此,本题正确答案是:<。
②设氮气的变化量为xmol,根据反应,
N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
起始量 9 23 0
变化量 x 3 x 2 x
平衡量 9- x 23-3x 2 x
氨气的体积分数= 2x÷(9- x+ 23-3x+2x)=60%,解之x=6mol;把x=6带入下式可得:
H2的物质的量分数=(23-3x)÷(9- x+ 23-3x+2x)=![]() ,此时H2的平衡分压为60×1/4=15;
,此时H2的平衡分压为60×1/4=15;
因此,本题正确答案是:15;
Ⅱ. ①根据图像曲线变化,随温度升高,N2和O2浓度增大,NO2浓度减小,故正反应为吸热反应,△H>0,
②A.容器内气体颜色不变,说明浓度不变,该反应达到反应限度,故A正确;
B.反应 2NO2(g) ![]() N2(g)+2O2(g)为气体体积增大的反应,如将该反应条件由恒温恒容改为恒温恒压,相当于减小压强,平衡正向移动,O2的百分含量将增大,故B错误;
N2(g)+2O2(g)为气体体积增大的反应,如将该反应条件由恒温恒容改为恒温恒压,相当于减小压强,平衡正向移动,O2的百分含量将增大,故B错误;
C.在恒温恒容时,向平衡体系通入NO2,相当于加压,平衡逆向移动,NO2转化率降低,故C正确;
D.增大压强,正逆反应速率都增大,但逆反应速率增大倍数大于正反应速率增大的倍数,平衡逆向移动,故D错误;
答案选BD。
③根据化学方程式2NO2(g) ![]() N2(g)+2O2(g)及图示数据,A点时,NO2是10mol,O2是10mol,N2是5mol,因为容器的总压为a Pa,所以N2的分压是
N2(g)+2O2(g)及图示数据,A点时,NO2是10mol,O2是10mol,N2是5mol,因为容器的总压为a Pa,所以N2的分压是![]() a Pa,NO2和O2的分压都是
a Pa,NO2和O2的分压都是![]() a Pa,则平衡常数Kp=
a Pa,则平衡常数Kp=![]() =
=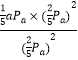 = a/5 Pa。
= a/5 Pa。
B点时,N2和NO2的物质的量相等,设为xmol,则O2为2xmol,NO2转化率为![]() ×100%=66.7%(或2/3)。
×100%=66.7%(或2/3)。
因此,本题正确答案是:a/5 Pa;66.7%(或2/3);
Ⅲ.设平衡时剩余N2O5的物质的量是x,所以消耗N2O5是2-x,则反应①中生成N2O3和氧气都是2-x。由于平衡时O2为0.75mol/L×2L=1.5mol,N2O为0.25 mol/L×2=0.5mol,所以反应②中生成氧气是0.5mol,则消耗N2O3是0.5mol,所以有(2-x)-0.5=0.25mol/L×2,解得x=1mol,
此时反应①的平衡常数为K=![]() =
=![]() =0.375,
=0.375,
因此,本题正确答案是:0.5;0.375。





