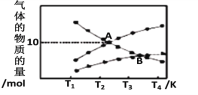
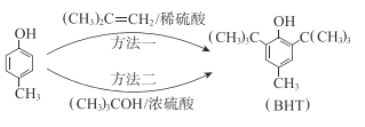
题目内容
【题目】(1)写出下列物质电离方程式:
Na2CO3__________________;
NH3·H2O_________________;
(2)写出下列物质水解的离子方程式:
NaHCO3__________________;
FeCl3___________________;
(3)常温时,0.1mol/L的NaOH和0.06mol/L 的H2SO4溶液等体积混合,求混合溶液的pH为_______。
(4)用pH试纸测定溶液pH的操作是____________。
【答案】Na2CO3=2Na++CO32-NH3H2ONH4++OH-HCO3-+H2OH2CO3+OH-Fe3++3H2OFe(OH)3+3H+2 取一小块pH试纸,用玻璃棒蘸取待测液,点在pH试纸的中部,变色后与标准比色卡对照读出pH值
【解析】
(1)碳酸钠属于强电解质,电离方程式为:Na2CO3=2Na++CO32-,NH3H2O为弱电解质,电离方程式为NH3H2ONH4++OH-,故答案为:Na2CO3=2Na++CO32-;NH3H2ONH4++OH-;
(2)碳酸氢钠水解生成碳酸和氢氧化钠,水解的离子方程式为HCO3-+H2OH2CO3+OH-,铁离子水解生成氢氧化铁和氢离子,水解的离子方程式为Fe3++3H2OFe(OH)3+3H+,故答案为:HCO3-+H2OH2CO3+OH-;Fe3++3H2OFe(OH)3+3H+;
(3)设两溶液体积为VL,0.1mol/LNaOH溶液中氢氧根离子物质的量是0.1Vmol,0.06mol/L的H2SO4溶液的物质的量是0.12Vmol,混合后酸剩余,所以剩余氢离子浓度c=![]() =0.01mol/L,即pH=2,故答案为:2;
=0.01mol/L,即pH=2,故答案为:2;
(4)在测定pH值时,不能湿润、稀释,正确的操作为:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸中部,变色后与标准比色卡对照读出pH值,故答案为:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸中部,变色后与标准比色卡对照读出pH值。

【题目】欲测定某NaOH溶液的物质的量浓度,可用0.100 0 mol·L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为________。
(2)滴定至终点的颜色变化为____________。
(3)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50 mL,滴定后液面如图,则此时消耗标准溶液的体积为__________。
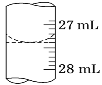
(4)乙学生做了三组平行实验,数据记录如下:
实验 序号 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1 HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为______。(保留四位有效数字)
(5)下列哪些操作会使测定结果偏高________(填字母)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数