��Ŀ����
����Ŀ������8��Ԫ�ص����ʡ��������±����У��������ڵڶ���������ڣ�
�� | �� | �� | �� | �� | �� | �� | �� | |
ԭ�Ӱ뾶��10��10m�� | 0.74 | 1.60 | 0.89 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
�����ͻ��ϼ� | +2 | +2 | +5 | +7 | +1 | +5 | +3 | |
��2 | ��3 | ��1 | ��3 |
�ش��������⣺
��1���۵�Ԫ�ط����� �� �ٵ�Ԫ�������� ��
��2������8��Ԫ�ص�����������ˮ�����У�������ǿ�Ļ������������ �� ������γɵĻ�����ĵ���ʽ�ǣ� �� �����������ӡ����ۡ�����
��3���ȽϢܺ͢ߵ��⻯����ȶ��ԣ��÷���ʽ��ʾ�� ��
��4��д��������������Ӧˮ����������������ﷴӦ�����ӷ���ʽ�� ��
��5�������ʵ��Ƚϵ��ʢڢ�Ľ����ԣ�д����ʵ�鲽������� ��
���𰸡�
��1��Be����
��2�������![]() ������
������
��3��NH3��PH3
��4��Al2O3+2OH��=2AlO2��+H2O
��5��ȡһС��þ����һСƬ��Ƭ��ĥȥ��������Ĥ���ֱ����2֧�Թ��У�������������Ũ�ȵ����ᣬþ�����ᷴӦ��������
���������⣺��Ԫ�ص����ʿ�֪����ֻ�Щ�2�ۣ����ΪO���ܡ����л��ϼ���ͬ���뾶��ͬ�����ΪP����ΪN����ΪCl�����ԭ�Ӱ뾶��֪����ΪMg����ΪBe����ΪNa����ΪAl����1���۵�Ԫ�ط�����Be���ٵ�Ԫ���������������Դ��ǣ�Be��������2����8��Ԫ�ص�����������ˮ�����У�������ǿ�Ļ�����������Ǹ����ᣮ������γɵĻ�����ΪMgCl2 �� �����ʽ�� ![]() �������Ӽ���Ϊ���ӻ�������Դ��ǣ������
�������Ӽ���Ϊ���ӻ�������Դ��ǣ������ ![]() �����ӣ���3���ǽ�����N��P����ܺ͢ߵ��⻯����ȶ���ΪNH3��PH3 �� ���Դ��ǣ�NH3��PH3����4��������������Ӧˮ����������������ﷴӦ�����ӷ���ʽΪAl2O3+2OH��=2AlO2��+H2O�����Դ��ǣ�Al2O3+2OH��=2AlO2��+H2O����5��������Mg��Al����Ƶļ�ʵ�鲽�������ΪȡһС��þ����һСƬ��Ƭ��ĥȥ��������Ĥ���ֱ����2֧�Թ��У�������������Ũ�ȵ����ᣬþ�����ᷴӦ�������ң� ������ˮ��ԭ��ء�����������ˮ����ļ��ԱȽϵȣ������Դ��ǣ�ȡһС��þ����һСƬ��Ƭ��ĥȥ��������Ĥ���ֱ����2֧�Թ��У�������������Ũ�ȵ����ᣬþ�����ᷴӦ�������ң�
�����ӣ���3���ǽ�����N��P����ܺ͢ߵ��⻯����ȶ���ΪNH3��PH3 �� ���Դ��ǣ�NH3��PH3����4��������������Ӧˮ����������������ﷴӦ�����ӷ���ʽΪAl2O3+2OH��=2AlO2��+H2O�����Դ��ǣ�Al2O3+2OH��=2AlO2��+H2O����5��������Mg��Al����Ƶļ�ʵ�鲽�������ΪȡһС��þ����һСƬ��Ƭ��ĥȥ��������Ĥ���ֱ����2֧�Թ��У�������������Ũ�ȵ����ᣬþ�����ᷴӦ�������ң� ������ˮ��ԭ��ء�����������ˮ����ļ��ԱȽϵȣ������Դ��ǣ�ȡһС��þ����һСƬ��Ƭ��ĥȥ��������Ĥ���ֱ����2֧�Թ��У�������������Ũ�ȵ����ᣬþ�����ᷴӦ�������ң�

 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�����Ŀ��25��ʱ����������ĵ���ƽ�ⳣ�����£�
���� | CH3COOH | H2CO3 | H2SO3 |
����ƽ�ⳣ�� | K=1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K1=1.5��10-2 K2=1.02��10-7 |
��1��CH3COOH��H2CO3��H2SO3��������������������__________(�ѧʽ)��
��2��CH3COOH�ĵ���ƽ�ⳣ������ʽΪK=__________��
��3��д��H2CO3�ĵڶ������뷽��ʽ��_____________��
��4��д��H2SO3��Һ��CH3COONa��Һ��Ӧ�����ӷ���ʽ��____________________��
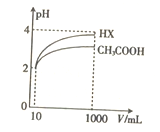
��5���������Ϊ10mL��pH��Ϊ2�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1000mL��ϡ������pH�ı仯��ͼ��ʾ����HX�ĵ���ƽ�ⳣ��____________(������������ С��������������)����ĵ���ƽ�ⳣ����������__________________��