题目内容
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
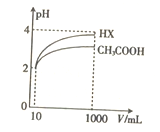
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是__________________。
【答案】 H2CO3  HCO3-
HCO3-![]() CO32-+H+ H2SO3+CH3COO-=HSO3-+CH3COOH 大于 pH值相同的醋酸溶液和HX溶液稀释相同的倍数时,HX的pH变化程度更大,则HX酸性更强,电离平衡常数更大
CO32-+H+ H2SO3+CH3COO-=HSO3-+CH3COOH 大于 pH值相同的醋酸溶液和HX溶液稀释相同的倍数时,HX的pH变化程度更大,则HX酸性更强,电离平衡常数更大
【解析】本题考查电离平衡常数、电离方程式的书写,(1)电离平衡常数越大,说明电离程度越大,三种酸酸性强弱的顺序是H2SO3>CH3COOH>H2CO3;(2)CH3COOH的电离:CH3COOH![]() CH3COO-+H+,依据电离平衡常数的表达式,即Ka=
CH3COO-+H+,依据电离平衡常数的表达式,即Ka= ;(3)碳酸是多元弱酸,其电离应是分步电离,电离方程式为H2CO3
;(3)碳酸是多元弱酸,其电离应是分步电离,电离方程式为H2CO3![]() H++HCO3-、HCO3-
H++HCO3-、HCO3-![]() H++CO32-或是H2CO3+H2O
H++CO32-或是H2CO3+H2O![]() H3O++HCO3-、HCO3-+H2O
H3O++HCO3-、HCO3-+H2O![]() H3O++CO32-,碳酸的第二步电离为:HCO3-
H3O++CO32-,碳酸的第二步电离为:HCO3-![]() H++CO32-或HCO3-+H2O
H++CO32-或HCO3-+H2O![]() H3O++CO32-;(4)根据上述表格数据,电离H+大小顺序是H2SO3>CH3COOH>HSO3-,利用电离平衡常数大的制备电离平衡常数小的,因此H2SO3和CH3COONa发生的离子反应是:H2SO3+CH3COO-=HSO3-+CH3COOH;(5)相同pH的两种酸,稀释相同倍数,酸性强的pH变化大,根据图像,稀释相同倍数,HX的pH变化大,因此HX的酸性强于CH3COOH。
H3O++CO32-;(4)根据上述表格数据,电离H+大小顺序是H2SO3>CH3COOH>HSO3-,利用电离平衡常数大的制备电离平衡常数小的,因此H2SO3和CH3COONa发生的离子反应是:H2SO3+CH3COO-=HSO3-+CH3COOH;(5)相同pH的两种酸,稀释相同倍数,酸性强的pH变化大,根据图像,稀释相同倍数,HX的pH变化大,因此HX的酸性强于CH3COOH。

【题目】在一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表.
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10﹣2 mol/(Lmin)
B.6~10 min的平均反应速率:v(H2O2)<3.3×10﹣2 mol/(Lmin)
C.反应到6 min时,H2O2分解了50%
D.反应到6 min时,c(H2O2)=0.30 mol/L
【题目】现有8种元素的性质、数据如下表所列,它们属于第二或第三周期.
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10﹣10m) | 0.74 | 1.60 | 0.89 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +2 | +5 | +7 | +1 | +5 | +3 | |
﹣2 | ﹣3 | ﹣1 | ﹣3 |
回答下列问题:
(1)③的元素符号是 , ①的元素名称是 .
(2)在这8种元素的最高价氧化物的水化物中,酸性最强的化合物的名称是 . ②与⑤形成的化合物的电子式是: , 属化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用分子式表示) .
(4)写出⑥最高价氧化物对应水化物跟⑧的最高价氧化物反应的离子方程式: .
(5)请设计实验比较单质②⑧的金属性,写出简单的实验步骤和现象: .