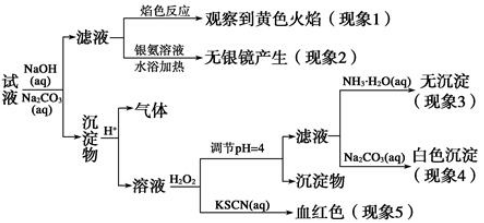
题目内容
下列叙述正确的是( )
| A.向FeSO4溶液中加入NaOH溶液,充分振荡后,可以制得Fe(OH)2 |
| B.Al2O3能和NaOH溶液反应,得到NaAlO2 |
| C.某溶液焰色反应的火焰呈黄色,则该溶液中不含钾离子 |
| D.某溶液中加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,则该溶液中一定有SO42- |
A、向FeSO4溶液中加入NaOH溶液,先生成白色沉淀,白色沉淀迅速变成灰绿色,最终会变成红褐色,所以无法获得Fe(OH)2,故A错误;
B、氧化铝为两性氧化物,所以Al2O3能和NaOH溶液反应生成NaAlO2和水,反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O,故B正确;
C、观察钾离子的焰色反应的火焰颜色时,需要通过蓝色的钴玻璃观察,否则无法可得紫色,所以某溶液焰色反应的火焰呈黄色,溶液中一定含有钠离子,但是无法确定溶液中是否含钾离子,故C错误;
D、某溶液中加入BaCl2溶液有白色沉淀产生,白色沉淀可能为氯化银,不一定为硫酸钡沉淀,所以不能确定该溶液中是否有SO42-,故D错误;
故选B.
B、氧化铝为两性氧化物,所以Al2O3能和NaOH溶液反应生成NaAlO2和水,反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O,故B正确;
C、观察钾离子的焰色反应的火焰颜色时,需要通过蓝色的钴玻璃观察,否则无法可得紫色,所以某溶液焰色反应的火焰呈黄色,溶液中一定含有钠离子,但是无法确定溶液中是否含钾离子,故C错误;
D、某溶液中加入BaCl2溶液有白色沉淀产生,白色沉淀可能为氯化银,不一定为硫酸钡沉淀,所以不能确定该溶液中是否有SO42-,故D错误;
故选B.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
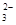 = 2Iˉ+S4O
= 2Iˉ+S4O