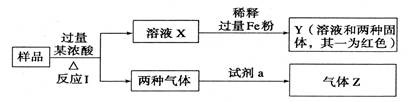
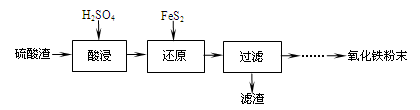
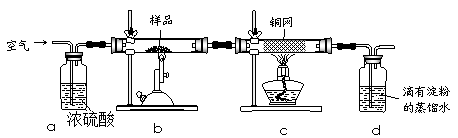
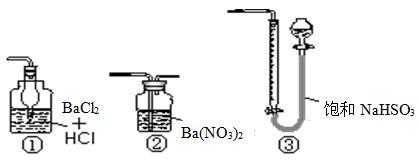
题目内容
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:(已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀)该同学得出的结论正确的是
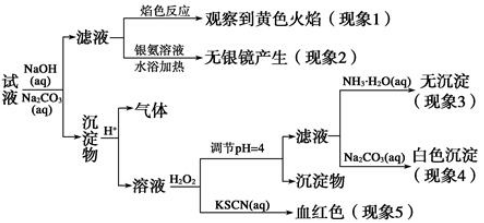

| A.根据现象1可推出该试液中含有Na+ |
| B.根据现象2可推出该试液中并不含有葡萄糖酸根 |
| C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+ |
| D.根据现象5可推出该试液中一定含有Fe2+ |
C
试题分析:A、由于试液中外加了NaOH和Na2CO3,故不能确定原试液中是否含有钠离子;B、试液中有没有葡萄糖酸根离子,都无银镜生成,因为葡萄糖酸根离子中不含醛基;C、滤液中加氨水无沉淀产生,说明无镁离子,加入碳酸钠溶液,有白色沉淀,说明有钙离子,C正确;D、试液中可能含亚铁离子,也可能只含铁离子而不含亚铁离子,D错误;故选C。

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目