题目内容
铝土矿的主要成分为Al2O3.生产铵明矾[NH4Al(SO4)2?12H2O]和H2O2的工艺流程图如下.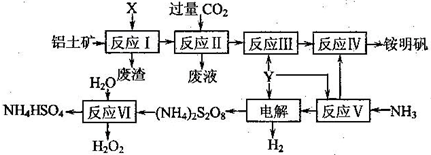
(1)流程图中X为______(填化学式)溶液.
(2)反应Ⅱ的离子方程式为______.
(3)“电解”时,用惰性材料作电极,则阴极反应可表示为______.
(4)反应Ⅵ的化学方程式为______.
(5)流程中可以循环使用的物质是______.
解:(1)根据反应Ⅱ中通入的是CO2气体,可见反应所加X是碱溶液,而不是酸溶液,X为NaOH溶液或其他强碱性溶液.
故答案为:NaOH.
(2)由工艺流程转化可知,反应Ⅱ为向含有AlO2-的反应Ⅰ的滤液中通入过量CO2气体,使AlO2-完全转化为Al(OH)3,在溶液中CO2、AlO2-、H2O反应生成Al(OH)3与HCO3-,反应离子方程式为CO2+AlO2-+2H2O=Al(OH)3+HCO3-.
故答案为:CO2+AlO2-+2H2O=Al(OH)3+HCO3-.
(3)电解时阴极是阳离子放电,发生还原反应,即H+放电产生氢气,电极反应式为2H++2e-=H2↑.
故答案为:2H++2e-=H2↑.
(4)由工艺流程转化可知,反应Ⅵ是H2O与(NH4)2S2O8反应产生H2O2和NH4HSO4,反应方程式为(NH4)2S2O8+2H2O=2NH4HSO4+H2O2.
故答案为:(NH4)2S2O8+2H2O=2NH4HSO4+H2O2.
(5)由工艺流程转化可知,Y为H2SO4,反应Ⅴ生成NH4HSO4,反应Ⅳ中NH4HSO4转化为铵明矾,反应Ⅵ也产生NH4HSO4,可见NH4HSO4可以在反应中循环使用.
故答案为:NH4HSO4.
分析:(1)根据反应Ⅱ中通入的是CO2气体,可见反应所加X是碱溶液,而不是酸溶液.
(2)由工艺流程转化可知,反应Ⅱ为向含有AlO2-的反应Ⅰ的滤液中通入过量CO2气体,使AlO2-完全转化为Al(OH)3,在溶液中CO2、AlO2-、H2O反应生成Al(OH)3与HCO3-.
(3)电解时阴极是阳离子放电,发生还原反应,即H+放电产生氢气.
(4)由工艺流程转化可知,反应Ⅵ是H2O与(NH4)2S2O8反应产生H2O2和NH4HSO4.
(5)由工艺流程转化可知,Y为H2SO4,反应Ⅴ生成NH4HSO4,反应Ⅳ中NH4HSO4转化为铵明矾,反应Ⅵ也产生NH4HSO4,可见NH4HSO4可以在反应中循环使用.
点评:考查学生对工艺流程的理解、阅读获取信息能力、方程式书写、电解池等,难度中等,需要学生具备阅读获取信息能力、综合运用知识、信息分析问题解决问题能力.
故答案为:NaOH.
(2)由工艺流程转化可知,反应Ⅱ为向含有AlO2-的反应Ⅰ的滤液中通入过量CO2气体,使AlO2-完全转化为Al(OH)3,在溶液中CO2、AlO2-、H2O反应生成Al(OH)3与HCO3-,反应离子方程式为CO2+AlO2-+2H2O=Al(OH)3+HCO3-.
故答案为:CO2+AlO2-+2H2O=Al(OH)3+HCO3-.
(3)电解时阴极是阳离子放电,发生还原反应,即H+放电产生氢气,电极反应式为2H++2e-=H2↑.
故答案为:2H++2e-=H2↑.
(4)由工艺流程转化可知,反应Ⅵ是H2O与(NH4)2S2O8反应产生H2O2和NH4HSO4,反应方程式为(NH4)2S2O8+2H2O=2NH4HSO4+H2O2.
故答案为:(NH4)2S2O8+2H2O=2NH4HSO4+H2O2.
(5)由工艺流程转化可知,Y为H2SO4,反应Ⅴ生成NH4HSO4,反应Ⅳ中NH4HSO4转化为铵明矾,反应Ⅵ也产生NH4HSO4,可见NH4HSO4可以在反应中循环使用.
故答案为:NH4HSO4.
分析:(1)根据反应Ⅱ中通入的是CO2气体,可见反应所加X是碱溶液,而不是酸溶液.
(2)由工艺流程转化可知,反应Ⅱ为向含有AlO2-的反应Ⅰ的滤液中通入过量CO2气体,使AlO2-完全转化为Al(OH)3,在溶液中CO2、AlO2-、H2O反应生成Al(OH)3与HCO3-.
(3)电解时阴极是阳离子放电,发生还原反应,即H+放电产生氢气.
(4)由工艺流程转化可知,反应Ⅵ是H2O与(NH4)2S2O8反应产生H2O2和NH4HSO4.
(5)由工艺流程转化可知,Y为H2SO4,反应Ⅴ生成NH4HSO4,反应Ⅳ中NH4HSO4转化为铵明矾,反应Ⅵ也产生NH4HSO4,可见NH4HSO4可以在反应中循环使用.
点评:考查学生对工艺流程的理解、阅读获取信息能力、方程式书写、电解池等,难度中等,需要学生具备阅读获取信息能力、综合运用知识、信息分析问题解决问题能力.

练习册系列答案
相关题目
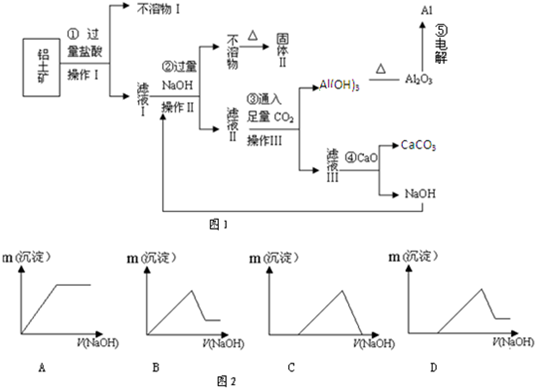


 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程: