题目内容
【题目】铬合金具有高硬度、耐腐蚀特性,广泛应用于精密仪器制造。由高碳铬铁合金废料粉末制取铬的简单流程如下:
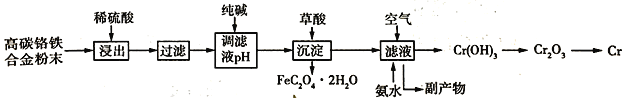
已知:Cr + H2SO4 = CrSO4 + H2↑
请回答下列问题:
(1)稀硫酸酸浸过程中,提高“浸出率”的措施有______________(合理、一条即可)
(2)用纯碱调节溶液酸度,若纯碱过量,则可能导致的后果是_________________,副产物直接排放环境不仅浪费,还污染水质。请你写出副产物的一个用途______________(合理给分)。
(3)加入草酸(H2C2O4)发生的离子方程式为__________________,铬属于难熔金属,写出工业中冶炼铬的化学方程式_________________。
(4)向滤液中通入空气,加入氨水后发生反应的化学方程式为_________________。
(5)已知高碳铬铁废料中铁铬元素质量之比为14:13。上述流程中铁元素转化为草酸亚铁的利用率为80%。废料中提取金属铬的总转化率为95%,如果得到草酸亚铁晶体(FeC2O42H2O)的质量为18.00 t ,则可以冶炼铬的质量为________t(结果保留1位小数)。
【答案】加热、搅拌、适当提高酸的浓度 Cr2+、Fe2+水解或沉淀 硫酸铵做化肥 Fe2+ + 2H2C2O4 + 2H2O = FeC2O42H2O↓ + 2H+ 2Al + Cr2O3 ![]() Al2O3 + 2Cr 8NH3H2O + 2H2O + O2 + 4CrSO4 = 4Cr(OH)3↓ + 4(NH4)2SO4 或者 8NH3 + 10H2O + O2 + 4CrSO4 = 4Cr(OH)3↓ + 4(NH4)2SO4 6.2
Al2O3 + 2Cr 8NH3H2O + 2H2O + O2 + 4CrSO4 = 4Cr(OH)3↓ + 4(NH4)2SO4 或者 8NH3 + 10H2O + O2 + 4CrSO4 = 4Cr(OH)3↓ + 4(NH4)2SO4 6.2
【解析】
高碳铬铁合金粉末溶于稀硫酸,发生的反应有Cr+H2SO4=CrSO4+H2↑、Fe+H2SO4=FeSO4+H2↑,过滤后滤出杂质,滤液中含有CrSO4、FeSO4、H2SO4,向滤液中加入纯碱,调节溶液的pH,降低溶液的酸性,然后向溶液中加入草酸,将亚铁离子转化为草酸亚铁沉淀,离子方程式为Fe2++H2C2O4+2H2O=FeC2O42H2O↓+2H+,过滤除去草酸亚铁沉淀,向滤液中通入空气、加入氨水,发生的反应为4CrSO4+O2+8NH3H2O+2H2O=4Cr(OH)3↓+4(NH4)2 SO4,将Cr(OH)3加热分解生成Cr2O3,然后利用热还原法冶炼得到Cr,据此分析解答。
(1)稀硫酸酸浸过程中,提高“浸出率”的措施有加热、搅拌、适当提高稀硫酸的浓度等,故答案为:加热、搅拌、适当提高稀硫酸浓度等(答案合理即可);
(2)用纯碱调节溶液酸度,若纯碱过量,铬离子、亚铁离子水解导致溶液呈酸性,纯碱水解导致溶液呈碱性,则加入纯碱过量会促进水解Cr2+、Fe2+,从而得到两种金属的氢氧化物沉淀;副产物中两种主要物质的化学式为Na2SO4、(NH4)2SO4,直接排放环境不仅浪费,还污染水质,回收的硫酸铵可以做化肥,故答案为:Cr2+、Fe2+水解成沉淀;硫酸铵做化肥;
(3)加入草酸,草酸和亚铁离子反应生成沉淀,离子方程式为Fe2++H2C2O4+2H2O=FeC2O42H2O↓+2H+;铬属于难熔金属,可以利用铝热反应冶炼铬,反应的化学方程式为Cr2O3+2Al ![]() Al2O3+2Cr,故答案为:Fe2++H2C2O4+2H2O=FeC2O42H2O↓+2H+;Cr2O3+2Al
Al2O3+2Cr,故答案为:Fe2++H2C2O4+2H2O=FeC2O42H2O↓+2H+;Cr2O3+2Al ![]() Al2O3+2Cr;
Al2O3+2Cr;
(4)向滤液中通入空气,加入氨水后,一水合氨、氧气、硫酸铬反应生成氢氧化铬沉淀和硫酸铵,反应的化学方程式为4CrSO4+O2+8NH3H2O+2H2O=4Cr(OH)3↓+4(NH4)2SO4,故答案为:4CrSO4+O2+8NH3H2O+2H2O=4Cr(OH)3↓+4(NH4)2SO4;
(5)废料中的Fe元素质量=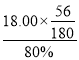 吨=7吨,高碳铬铁度料中铁铭元素质量比为14∶13,则Cr元素质量=
吨=7吨,高碳铬铁度料中铁铭元素质量比为14∶13,则Cr元素质量=![]() ×13=6.5吨,废料中提取金属铬的总转化率为95%,则提取的Cr质量=6.5吨×95%=6.2吨,故答案为:6.2。
×13=6.5吨,废料中提取金属铬的总转化率为95%,则提取的Cr质量=6.5吨×95%=6.2吨,故答案为:6.2。

【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D