题目内容
【题目】(1)硼的研究在无机化学发展中占有独特的位置。硼元素有10B 和 11B 两种天然稳定的同位素,在基态 11B 原子中,核外存在______对自旋状态相反的电子,有_______种不同空间运动状态的电子。根据对角线规则,硼元素许多性质与_____元素相似;
(2)NH3 能通过配位键与硼元素的某种氢化物作用得到化合物M,M是一种新的储氢材料,加热M会缓慢释放出H2,并转化为化合物N,M、N分别是乙烷、乙烯的等电子体。 M的结构式为______________(须标出配位键),N分子中的π键和σ键数目之比为_______________;
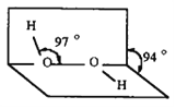
(3)O 和 S 两种元素是自然界最常见的两种元素。均能与 H 形成 H2O2 和 H2S2,结构如图所示。请说明 H2O2 中 ∠H-O-O = 97° 略大于 ∠H-S-S = 95° 的原因: ______________;
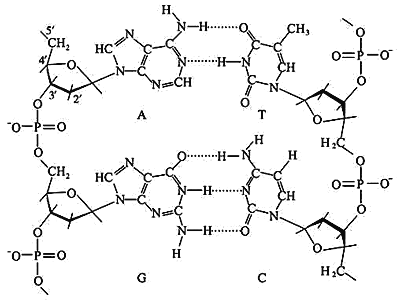
(4)下图为DNA结构局部图。双链通过氢键使它们的碱基(A T 和 C G )相互配对形成双螺旋结构,请写出图中存在的两种氢键的表示式____________,_____________;
(5)通常认为含氧酸的通式可写成 (HO)mROn ,n值越高,则酸性越强。可实际上,二氧化碳的水溶液酸性很弱,通常认为是弱酸,但磷酸(H3PO4)的非羟基氧个数与碳酸(H2CO3)相同,却是中强酸,请解释原因:____________________;
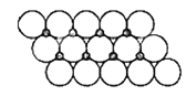
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2作密置单层排列,Ni2+ 填充其中;已知O2的半径为am,阿伏加德罗常数NA,则每平方米上分散的该晶体的质量为_______________g。(写出表达式即可。图中大白球表示O2,小黑球表示 Ni2+)
【答案】2 3 Si 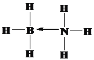 1:5 O,S采取的杂化和孤对电子数相同,但氧原子电负性大,价层电子密度高,故相互间排斥作用更强,键角更大 N—H O N—H N 溶于水的CO2分子只有约几百分之一与水结合成碳酸
1:5 O,S采取的杂化和孤对电子数相同,但氧原子电负性大,价层电子密度高,故相互间排斥作用更强,键角更大 N—H O N—H N 溶于水的CO2分子只有约几百分之一与水结合成碳酸 ![]() 或
或 ![]()
【解析】
(1)B为5号元素,在基态11B原子中,电子排布式为1s22s22p1,在周期表中,B与Si位于对角线位置,据此分析判断;
(2)M是NH3与硼元素的氢化物相互作用的产物,M是乙烷的等电子体,说明M中含有8个原子、价电子数是14,则M为BH3NH3;N是乙烯的等电子体,应为BH2=NH2,据此分析解答;
(3)O,S采取的杂化和孤对电子数相同,但氧原子电负性大,价层电子密度高,故相互间排斥作用更强,据此分析解答;
(4)根据图示判断存在的氢键;
(5)根据CO2溶于水的程度不大,且与水结合的CO2的数量更小分析解答;
(6) 根据图片知,平面NiO基本结构单元为![]() ,每个机构单元含有1个“NiO” ,首先计算每个氧化镍所占的面积和每个氧化镍的质量,再计算每平方米含有的氧化镍个数和含有的氧化镍质量。
,每个机构单元含有1个“NiO” ,首先计算每个氧化镍所占的面积和每个氧化镍的质量,再计算每平方米含有的氧化镍个数和含有的氧化镍质量。
(1)B为5号元素,在基态11B原子中,电子排布式为1s22s22p1,同一轨道中两个电子自旋方向相反,核外存在2对自旋状态相反的电子;核外电子空间运动状态由能层、能级、原子轨道决定,1s轨道、2s轨道、2p有1个轨道,有3种不同空间运动状态的电子;在周期表中,B与Si位于对角线位置,根据对角线规则,硼元素许多性质与Si元素相似,故答案为:2;3;Si;
(2)M是NH3与硼元素的氢化物相互作用的产物,M是乙烷的等电子体,说明M中含有8个原子、价电子数是14,则M为BH3NH3,M中B含有空轨道,N含有孤电子对,可形成配位键,M结构式为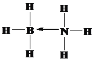 ;N是乙烯的等电子体,应为BH2=NH2,N分子中含有1个π键,σ键包括2个B-H、2个N-H和1个B-N,共5个,π键和σ键数目之比为1:5,故答案为:
;N是乙烯的等电子体,应为BH2=NH2,N分子中含有1个π键,σ键包括2个B-H、2个N-H和1个B-N,共5个,π键和σ键数目之比为1:5,故答案为: ;1:5;
;1:5;
(3)O,S采取的杂化和孤对电子数相同,但氧原子电负性大,价层电子密度高,故相互间排斥作用更强,键角更大,使得H2O2 中 ∠H-O-O 略大于 ∠H-S-S,故答案为:O,S采取的杂化和孤对电子数相同,但氧原子电负性大,价层电子密度高,故相互间排斥作用更强,键角更大;
(4)根据图示,图中存在的氢键的表示式为N—H O和N—H N,故答案为:N—H O;N—H N;
(5)H2CO3与H3PO4均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸,由于CO2溶于水的程度不大,与水结合的CO2的数量更小,只有约几百分之一与水结合成碳酸,与按二氧化碳全部转化为碳酸分子来估算酸的强度相比,自然就小了近百倍了,故答案为:溶于水的二氧化碳分子只有约几百分之一与水结合成碳酸;
(6)根据图片知,平面NiO基本结构单元为![]() ,每个机构单元含有1个“NiO” ,每个氧化镍所占的面积=(2×am)×(2×am×sin60°)=2
,每个机构单元含有1个“NiO” ,每个氧化镍所占的面积=(2×am)×(2×am×sin60°)=2![]() a2m2,则每平方米含有的氧化镍个数=
a2m2,则每平方米含有的氧化镍个数=![]() ,每个氧化镍的质量=
,每个氧化镍的质量=![]() g,所以每平方米含有的氧化镍质量=
g,所以每平方米含有的氧化镍质量=![]() ×
×![]() g=
g=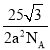 ,故答案为:
,故答案为: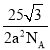 。
。

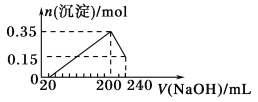
【题目】现有四种溶液:A.盐酸B.稀硫酸C.NaOH溶液D.Ba(OH)2溶液。这些溶液溶质物质的量浓度均为0.3mol/L。根据溶液取用情况,判断得到的溶液中存在的主要离子及其浓度;或者根据最终离子的情况,推断最终溶液可能是哪些溶液按怎样的体积比混合的结果(忽略溶液混合后的体积变化)
溶液取用情况 | 溶液中存在的主要离子及其浓度 |
溶液A和B按体积比2:1混合 | ①____________ |
②____________ | Na+和Cl﹣物质的量浓度均为0.15 mol/L |
等体积混合溶液B和C | ③____________ |
溶液A和D按体积比2:1混合 | ④____________ |
⑤____________ | Ba2+物质的量浓度为0.1 mol/L,OH﹣物质的量浓度为0.2 mol/L |