题目内容
【题目】将Mg和Al形成的合金m g 完全溶于足量的盐酸中,得到标准状况下H2的体积为2.24L。现向反应后的溶液中加入足量的氨水,过滤、洗涤并充分灼烧得到n g 固体,则n 值为
A. m + 3.4B. m + 1.6C. ![]() D. 无法计算
D. 无法计算
【答案】B
【解析】
n(H2)=![]() =0.1 mol,Mg、Al合金分别和足量稀盐酸反应生成氯化物和氢气,氯化镁、氯化铝和足量氨水反应分别生成Mg(OH)2、Al(OH)3沉淀,所以最后得到的沉淀是氢氧化镁和氢氧化铝的混合物,一个电子带一个单位负电荷、一个氢氧根离子带一个单位负电荷,所以镁铝合金失去电子的物质的量与生成氢氧化物需要氢氧根离子的物质的量相等,根据转移电子相等知,镁铝失电子物质的量=0.1 mol×2=0.2 mol,则沉淀中n(OH-)=0.2 mol,0.2mol OH-可以看做0.1molO和0.1molH2O,过滤、洗涤并充分灼烧得到n g 固体,固体的质量=合金的质量m+O的质量,则固体质量n=m(合金)+m(O)=mg+0.1mol×16g/mol=(m + 1.6)g,故选B。
=0.1 mol,Mg、Al合金分别和足量稀盐酸反应生成氯化物和氢气,氯化镁、氯化铝和足量氨水反应分别生成Mg(OH)2、Al(OH)3沉淀,所以最后得到的沉淀是氢氧化镁和氢氧化铝的混合物,一个电子带一个单位负电荷、一个氢氧根离子带一个单位负电荷,所以镁铝合金失去电子的物质的量与生成氢氧化物需要氢氧根离子的物质的量相等,根据转移电子相等知,镁铝失电子物质的量=0.1 mol×2=0.2 mol,则沉淀中n(OH-)=0.2 mol,0.2mol OH-可以看做0.1molO和0.1molH2O,过滤、洗涤并充分灼烧得到n g 固体,固体的质量=合金的质量m+O的质量,则固体质量n=m(合金)+m(O)=mg+0.1mol×16g/mol=(m + 1.6)g,故选B。

 优质课堂快乐成长系列答案
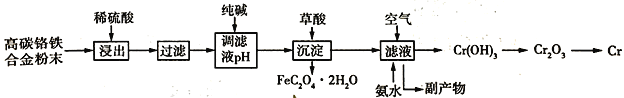
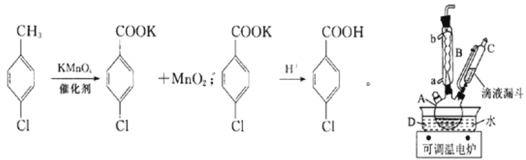
优质课堂快乐成长系列答案【题目】实验室中制备对氯苯甲酸的反应以及装置如图所示:
常温下,物质的有关数据和性质如表所示:
熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 颜色 | 水溶性 | |
对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
实验步骤:在规格为250mL的仪器A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩,冷却,然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量。
请回答下列问题:
(1)仪器A的名称为______________________。
(2)仪器B是冷凝管,其起到的主要作用是:________________,实验过程中,冷却水从________口。
(3)实验过程中两次过滤、洗涤操作,第一次过滤的滤渣成分为___________(填化学式),洗涤该滤渣用热水,目的是_________________________________,第二次过滤后,洗涤滤渣用冷水,目的是______________________。
(4)过滤、洗涤操作中能用到的仪器是___________(填选项字母)。
a.烧杯 b.分液漏斗 c.锥形瓶 d.玻璃棒
(5)第一次过滤后的滤液中加入硫酸,出现的现象是___________。
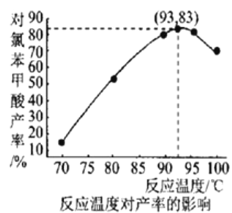
(6)如图是温度对对氯苯甲酸产率的影响关系,最后干燥、称量得到的对氯苯甲酸的质量为___________(保留小数点后两位)。