题目内容
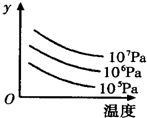 (2011?中山三模)某密闭容器中,可逆反应 L(s)+G(g)?3R(g);△H>0,如图表示外界条件温度、压强的变化对上述反应的影响.下列表述正确的是( )
(2011?中山三模)某密闭容器中,可逆反应 L(s)+G(g)?3R(g);△H>0,如图表示外界条件温度、压强的变化对上述反应的影响.下列表述正确的是( )分析:A、催化剂缩短达到平衡的时间,但平衡不移动;
B、L是固体,增大L的量,不影响平衡移动;
C、由图象可知温度相同时,压强越高y值越大;压强不变时,温度越高y值越小.据此结合方程式判断;
D、由图象可知温度相同时,压强越高y值越大;压强不变时,温度越高y值越小.据此结合方程式判断.
B、L是固体,增大L的量,不影响平衡移动;
C、由图象可知温度相同时,压强越高y值越大;压强不变时,温度越高y值越小.据此结合方程式判断;
D、由图象可知温度相同时,压强越高y值越大;压强不变时,温度越高y值越小.据此结合方程式判断.
解答:解:A、使用催化剂,同等程度加快正逆反应速率,平衡不移动,G的转化率不变,故A错误;
B、L是固体,增大L的量,浓度不变,不影响平衡移动,G的转化率不变,故B错误;
C、由图象可知温度相同时,压强越高y值越大;压强不变时,温度越高y值越小.y若是平衡混合气中G的质量分数,由可逆反应 L(s)+G(g)?3R(g);△H>0,可知温度相同时,压强增大,平衡向逆反应,G的质量分数增大;压强不变时,温度增大,平衡向正反应移动,G的质量分数减小,符合图象变化,故C正确;
D、由图象可知温度相同时,压强越高y值越大;压强不变时,温度越高y值越小.y若是达到平衡时G的转化率,由可逆反应 L(s)+G(g)?3R(g);△H>0,可知温度相同时,压强增大,平衡向逆反应,G的转化率降低;压强不变时,温度增大,平衡向正反应移动,G的转化率增大,不符合图象变化,故D错误.
故选C.
B、L是固体,增大L的量,浓度不变,不影响平衡移动,G的转化率不变,故B错误;
C、由图象可知温度相同时,压强越高y值越大;压强不变时,温度越高y值越小.y若是平衡混合气中G的质量分数,由可逆反应 L(s)+G(g)?3R(g);△H>0,可知温度相同时,压强增大,平衡向逆反应,G的质量分数增大;压强不变时,温度增大,平衡向正反应移动,G的质量分数减小,符合图象变化,故C正确;
D、由图象可知温度相同时,压强越高y值越大;压强不变时,温度越高y值越小.y若是达到平衡时G的转化率,由可逆反应 L(s)+G(g)?3R(g);△H>0,可知温度相同时,压强增大,平衡向逆反应,G的转化率降低;压强不变时,温度增大,平衡向正反应移动,G的转化率增大,不符合图象变化,故D错误.
故选C.
点评:本题考查平衡图象、外界条件对化学平衡的影响,难度中等,利用定一议二原则判断y的值随温度、压强的变化是解题关键.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目