题目内容
(2011?中山三模)下列有关表述正确的是( )
分析:A.氯化铵为强酸弱碱盐,溶液水解呈酸性;
B.从物料守恒的角度分析;
C.电荷不守恒;
D.过量的NaHSO4与Ba(OH)2溶液反应,反应n(Ba2+):n(OH-)=1:2,以此判断.
B.从物料守恒的角度分析;
C.电荷不守恒;
D.过量的NaHSO4与Ba(OH)2溶液反应,反应n(Ba2+):n(OH-)=1:2,以此判断.
解答:解:A.氯化铵为强酸弱碱盐,溶液水解呈酸性,则有c(H+)>c(OH-),盐类的水解一般程度较小,则有c(NH4+)>c(H+),则有c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A正确;
B.从物料守恒的角度思考,应存在:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故B错误;
C.离子方程式应为2Fe3++Cu=2Fe2++Cu2+,故C错误;
D.过量的NaHSO4与Ba(OH)2溶液反应,Ba(OH)2完全反应,反应存在n(Ba2+):n(OH-)=1:2的关系,离子方程式为
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D正确.
故选AD.
B.从物料守恒的角度思考,应存在:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故B错误;
C.离子方程式应为2Fe3++Cu=2Fe2++Cu2+,故C错误;
D.过量的NaHSO4与Ba(OH)2溶液反应,Ba(OH)2完全反应,反应存在n(Ba2+):n(OH-)=1:2的关系,离子方程式为
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D正确.
故选AD.
点评:本题考查较为综合,涉及盐类的水解、离子浓度的大小比较、离子方程式等问题,题目难度中等,本题易错点为D,注意把握反应物的用量关系,为难点,也是易错点.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
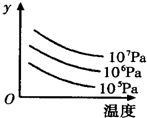 (2011?中山三模)某密闭容器中,可逆反应 L(s)+G(g)?3R(g);△H>0,如图表示外界条件温度、压强的变化对上述反应的影响.下列表述正确的是( )
(2011?中山三模)某密闭容器中,可逆反应 L(s)+G(g)?3R(g);△H>0,如图表示外界条件温度、压强的变化对上述反应的影响.下列表述正确的是( )