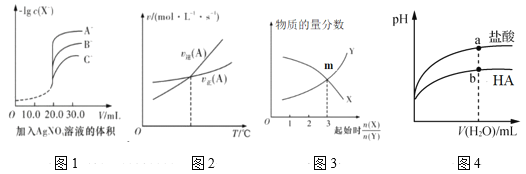
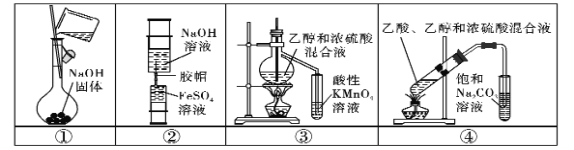
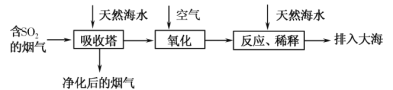
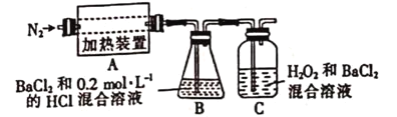
题目内容
【题目】8.8g FeS与400mL 1 mol/L硝酸溶液恰好完全反应,反应后产物为Fe2(SO4)3和Fe(NO3)3, X、H2O,则X为( )
A.N2B.NOC.N2OD.NO2
【答案】B
【解析】
8.8g FeS物质的量为0.1mol,400mL 1 mol/L硝酸物质的量为0.4mol,两者恰好完全反应,反应后产物为Fe2(SO4)3和Fe(NO3)3,铁化合价变为+3价,硫由-2价变为+6价,因此失去电子为0.1mol×1 + 0.1mol×8 = 0.9mol,根据硫守恒,生成了![]() Fe2(SO4)3,根据铁守恒生成了
Fe2(SO4)3,根据铁守恒生成了![]() Fe(NO3)3,根据氮守恒,有0.3mol氮得到0.9mol电子,从而得到每个氮降低3个价态,因此硝酸+5价变为+2价,故B正确。
Fe(NO3)3,根据氮守恒,有0.3mol氮得到0.9mol电子,从而得到每个氮降低3个价态,因此硝酸+5价变为+2价,故B正确。
综上所述,答案为B。

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目