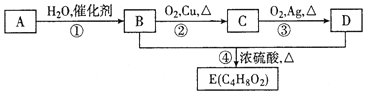
题目内容
【题目】(1)金属钠是一种非常活泼的金属,通常保存________中。把钠投入硫酸铜溶液中,发生反应的离子方程式为__________、_______。
(2)有一透明溶液,可能含有![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 等离子中的一种或几种。现加入
等离子中的一种或几种。现加入![]() 粉末有无色无味的气体放出,同时析出白色沉淀。假设溶液中的水足量,加入
粉末有无色无味的气体放出,同时析出白色沉淀。假设溶液中的水足量,加入![]() 的量与生成白色沉淀的量之间的关系如图来表示。试推断:
的量与生成白色沉淀的量之间的关系如图来表示。试推断:
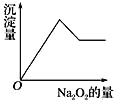
①原溶液中一定含有的离子是_________________;
②一定不含有的离子是________________;
③可能含有__________;为了进一步确定可能含有该离子,可增加焰色反应的实验,透过蓝色钴玻璃观察到的火焰的颜色为______色。
【答案】煤油 2Na + 2H2O=2Na++2OH- + H2↑ Cu2++2OH-═Cu(OH)2↓ Mg2+、Al3+ Fe3+、Cu2+ K+ 紫
【解析】
(1)钠常温下能与O2、H2O等物质反应,所以应该密封保存;钠投入硫酸铜溶液中,钠先与水反应生成氢氧化钠和氢气,然后铜离子与氢氧化钠溶液反应生成氢氧化铜沉淀,据此分析解答;
(2) 根据析出白色沉淀判断Fe3+、Cu2+是否存在,根据图像先生成白色沉淀,后沉淀部分溶解,判断Mg2+、Al3+是否存在,据此分析解答。
(1)钠常温下能与O2、H2O等物质反应,所以应该密封保存,钠通常密封保存于煤油中;钠投入硫酸铜溶液中,钠先与水反应生成氢氧化钠和氢气,然后铜离子与氢氧化钠溶液反应生成氢氧化铜沉淀,反应的离子方程式为:2Na + 2H2O=2Na++OH- + H2↑、Cu2++2OH-═Cu(OH)2↓,故答案为:煤油;2Na + 2H2O=2Na++OH- + H2↑;Cu2++2OH-═Cu(OH)2↓;
(2) 加入Na2O2粉末,过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,并同时析出白色沉淀,因此不含有铁离子和铜离子;可以含有Al3+、Mg2+中的一种或两种;当加入过量的过氧化钠时,先生成白色沉淀,后沉淀部分溶解,推断一定有Mg2+、Al3+,可能含有K+;
①原溶液中一定含有的离子是Al3+、Mg2+,故答案为:Al3+、Mg2+;
②原溶液中一定不含有的离子是Fe3+、Cu2+,故答案为:Fe3+、Cu2+;
③原溶液中可能含有K+;为了进一步确定可能含有该离子,用洁净的铂丝蘸取待测液,在酒精灯上灼烧,透过蓝色钴玻璃观察火焰的颜色,火焰呈紫色,说明含有K+,故答案为:K+;紫。