题目内容
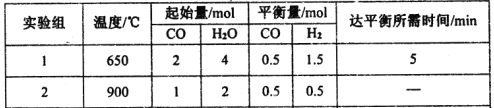
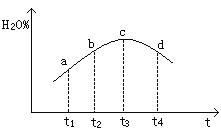
【题目】把在空气中久置的铝片5.0g投入盛有50mL0.1molL-1盐酸溶液的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系,可用如图所示的坐标曲线来表示,下列推论错误的是
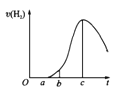
A.O→a段不产生氢气是因为表面的氧化物隔离了铝和稀盐酸
B.b→c段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时刻,反应处于平衡
D.t>c时,产生氢气的速率降低的主要原因是溶液中H+浓度下降
【答案】C
【解析】
试题分析:A、由于铝是活泼的金属,其表面有氧化膜,因此曲线O→a段不产生氢气,有关反应的化学方程式为Al2O3+6HCl=2AlCl3+3H2O,A正确;B、影响反应速率的因素一般是温度和浓度,随之反应的进行浓度是逐渐降低,则曲线b→c段产生氢气的速率增加较快的主要原因应该是反应放热,溶液温度升高,反应速率加快,B正确;C、该反应不是可逆反应,不存在平衡状态,C错误;D、影响反应速率的因素一般是温度和浓度,随之反应的进行浓度是逐渐降低,则t>c时,产生氢气的速率降低的主要原因是溶液中H+浓度下降导致。D正确,答案选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目