题目内容
20.0.56g CaO正好与20mL盐酸反应,这种盐酸的物质的量浓度是( )| A. | 0.10mol/L | B. | 0.20mol/L | C. | 0.50mol/L | D. | 1.00mol/L |
分析 根据n=$\frac{m}{M}$计算CaO的物质的量,再根据CaO+2HCl=CaCl2+H2O计算盐酸的物质的量和浓度.
解答 解:0.5g CaO的物质的量为n=$\frac{m}{M}$=$\frac{0.56g}{56g/mol}$=0.01mol,由反应方程式CaO+2HCl=CaCl2+H2O可知,n(HCl)=2n(CaO)=0.02mol,
则盐酸的物质的量浓度c=$\frac{n}{V}$=$\frac{0.02mol}{0.02L}$=1mol/L;
故选D.
点评 本题考查了物质的量浓度和有关方程式的计算,题目难度不大,侧重于考查学生对基本公式的应用能力.

练习册系列答案
相关题目
11.我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
则羊毛的编号为③,棉花的编号为②,涤纶的编号为①.
| 纤维编号 | ① | ② | ③ |
| 灼烧时的气味 | 特殊气味 | 烧纸气味 | 烧焦羽毛气味 |
8.在强酸性溶液,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+ K+ OH- Cl- | B. | Na+ Fe3+ SO42- NO3- | ||
| C. | Mg2+ Na+ SO42- Cl- | D. | Ba2+ HCO3- NO3- K+ |
8.下列描述及热化学方程式均正确的是( )
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)═6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ•mol-1 |

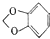
 (填结构简式).
(填结构简式).



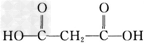 .
.