题目内容
12.向50mL 1mol/L AlCl3溶液中加入1.5mol/L NaOH溶液amL,充分反应后,生成的沉淀物为0.02mol;a的数值可能是( )| A. | 40 | B. | 65 | C. | 90 | D. | 120 |
分析 n(AlCl3)=1mol/L×0.05L=0.05mol,沉淀为氢氧化铝,氢氧化铝的物质的量是0.02mol<0.05mol,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算需要氢氧化钠溶液体积.
解答 解:n(AlCl3)=1mol/L×0.05L=0.05mol,沉淀为氢氧化铝,氢氧化铝的物质的量是0.02mol<0.05mol,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
一:氯化铝沉淀不完全时,根据Al3++3OH-═Al(OH)3↓知,n(NaOH)=3n[Al(OH)3]=3×0.02mol=0.06mol,则a=$\frac{0.06mol}{1.5mol/L}$=40mL;
二:生成的沉淀部分溶解,根据Al原子守恒知,溶解n[Al(OH)3]=0.05mol-0.02mol=0.03mol,
根据Al3++3OH-═Al(OH)3↓知,铝离子完全溶解消耗n(NaOH)=3n(Al3+)=3×0.05mol=0.15mol;
根据Al(OH)3 +OH-═AlO2-+2H2O知,溶解0.03mol氢氧化铝消耗n(NaOH)=n[Al(OH)3]=0.03mol,所以总共消耗n(NaOH)=(0.05+0.03)mol=0.18mol,则a=$\frac{0.18mol}{1.5mol/L}$=120mL,
故选AD.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,注意要分两种情况计算,很多学生往往漏掉氢氧化铝溶解而导致错误,为易错题.

 启东小题作业本系列答案
启东小题作业本系列答案| A. | C2H6 | B. | C3H8 | C. | C3H6 | D. | C3H4 |
| A. | 0.10mol/L | B. | 0.20mol/L | C. | 0.50mol/L | D. | 1.00mol/L |
| A. |  | B. | 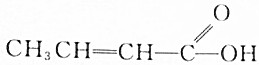 | ||
| C. | 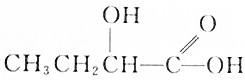 | D. | 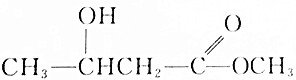 |

已知:Ag2SO4+4S2O32-═2[Ag(S2O3)2]3-+SO42-、Ag2CO3+4S2O32-═2[Ag(S2O3)2]3-+CO32-则下列说法中正确的是( )
| A. | 试样溶液中肯定存在S2O32-、CO32-,可能含有NH4+、Al3+、K+ | |
| B. | 沉淀1的成分肯定为BaSO4和S的混合物 | |
| C. | 将少量气体1通入溶液2中肯定会产生白色沉淀 | |
| D. | 取少量溶液1滴加KSCN溶液,溶液显红色 |
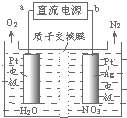 发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.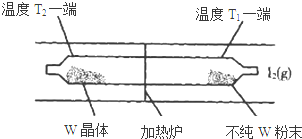 利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)?WI2(g)△H<0.
利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)?WI2(g)△H<0.