题目内容
9.已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g)?CO2(g)+H2(g),在427℃时的平衡常数是9.如果反应开始时,一氧化碳和水蒸气的浓度都是0.01mol/L,计算一氧化碳在此反应条件下的转化率.(要求写出计算过程,只写结果不给分)分析 设一氧化碳的浓度变化量为xmol/L,则:
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L):0.01 0.01 0 0
变化量(mol/L):x x x x
平衡量(mol/L):0.01-x 0.01-x x x
再根据平衡常数K=$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$=9列方程计算解答.
解答 解:设一氧化碳的浓度变化量为xmol/L,则:
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L):0.01 0.01 0 0
变化量(mol/L):x x x x
平衡量(mol/L):0.01-x 0.01-x x x
则K=$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{x×x}{(0.01-x)×(0.01-x)}$=9,解得:x=0.0075,
故CO转化率=$\frac{0.0075mol/L}{0.01mol/L}$×100%=75%,
故:平衡时CO的转化率为75%.
点评 本题考查化学平衡有关计算,比较基础,注意三段式在化学平衡计算中应用,掌握化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等.

练习册系列答案
相关题目
20.0.56g CaO正好与20mL盐酸反应,这种盐酸的物质的量浓度是( )
| A. | 0.10mol/L | B. | 0.20mol/L | C. | 0.50mol/L | D. | 1.00mol/L |
14.某矿物X由Al2O3、Fe2O3、Cu2O、SiO2中的一种或几种物质组成.现进行如图所示实验:
(已知:Cu2O+2H+═Cu+Cu2++H2O)( )

(已知:Cu2O+2H+═Cu+Cu2++H2O)( )
| A. | 步骤1中减少的固体一定是混合物 | |
| B. | 根据上述步骤可以判断矿物X中$\frac{n(F{e}_{2}{O}_{3})}{n(C{u}_{2}O)}$<1 | |
| C. | 根据步骤2可以得出蓝色溶液中n(Cu2+)=0.02mol | |
| D. | 根据步骤1、2可以判断出X中氧化铁的质量分数为50% |
18.只用一种试剂即可鉴别氯化镁、氯化铁、氯化亚铁、氯化铵、氯化钠这五种溶液,该试剂是( )
| A. | KSCN | B. | BaCl2 | C. | HCl | D. | NaOH |
19.已知室温下某溶液由水电离出的氢离子浓度是10-12mol/L,在此溶液中肯定能大量共存的离子组是( )
| A. | NO3-、NH4+、K+、SO42- | B. | CO32-、Cl-、Na+、K+ | ||
| C. | Mg2+、NO3-、C1-、Fe2+ | D. | K+、Na+、NO3-、SO42- |
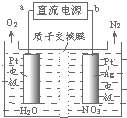 发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.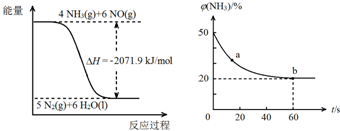
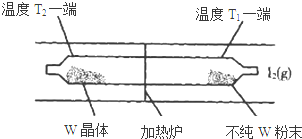 利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)?WI2(g)△H<0.
利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)?WI2(g)△H<0.