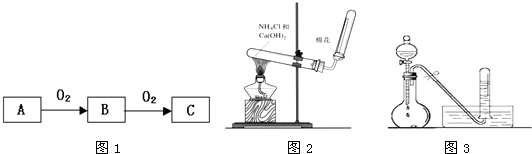
题目内容
 A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如图所示转化关系(这些转化关系都不需要使用催化剂),回答下列问题:
A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如图所示转化关系(这些转化关系都不需要使用催化剂),回答下列问题:(1)若甲在转化中为还原剂,是常见金属,乙是常见非金属因态单质,且甲、乙、丙都由短周期元素组成,则A的结构式是
O=C=O
O=C=O
;B的电子式是Mg2+

Mg2+
;A与甲反应的化学方程式是
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
(2)若甲在转化中为氧化剂,是常见的非金属气态单质,丙是常见金属,甲、乙、丙中只有甲由短周期元素组成,乙与甲同主族,与丙同周期,乙也有强氧化性,通常条件下都在溶液中进行反应,则:
①A与乙反应的离子方程式为:
2Fe2++Br2=2Fe3++2Br-
2Fe2++Br2=2Fe3++2Br-
②C与丙反应的离子方程式为:
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
③当A与甲的物质的量之比为2:3时,A与甲恰好完全反应,且符合图1所示的转化关系,则反应的离子方程式为:
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
.分析:A(化合物)+甲(单质)→B(化合物)+乙(单质),这是一个置换反应,对中学见到过的置换反应进行“扫描”,可以联系许多知识,能起到系统归纳、综合概括的作用.在(2)小问中,甲是“非金属”“气态”“单质”,符合这一条件的只有H2、N2、O2、F2、Cl2(稀有气体除外),其中的H2是还原性气体,与题中所说的强氧化性不符,再对余下的4种气体进行验证.题目隐含有两条信息:一是第(2)小题,甲、乙、丙中只有甲由短周期元素组成,言外之意,乙和丙都不是由短周期元素组成,进一步推理:乙、丙可能由第4、5 周期元素组成,中学常见的元素有Fe、Cu、K、Ca、Br、I等.二是由框图中“加入过量丙”和“加入不足量丙”暗示:乙和丙的反应一定是一个多步反应,随着反应物量的比例变化,产物发生变化.结合铁元素有可变化合价,从而可得出所有物质组成.A是FeBr2,B是FeCl3,C是FeBr3,甲是Cl2,
乙是Br2,丙是Fe.
乙是Br2,丙是Fe.
解答:解:
(1)因甲在转化中为还原剂,是常见金属,乙是常见非金属固态单质,且甲、乙、丙都由短周期元素组成,符合此条件的是镁(甲)与二氧化碳(A)发生反应生成氧化镁(B)和碳单质(乙),碳在足量氧气中燃烧生成二氧化碳,在不足量氧气中燃烧生成一氧化碳(C),二氧化碳和碳可化合为一氧化碳.故A为二氧化碳,结构式为:O=C=O,
B为氧化镁,电子式为:
Mg2+ ,二氧化碳与镁反应的方程式为:2Mg+CO2
,二氧化碳与镁反应的方程式为:2Mg+CO2
2MgO+C,
故答案为:O=C=O;Mg2+ ;2Mg+CO2
;2Mg+CO2
2MgO+C;
(2)甲是“非金属”“气态”“单质”,符合这一条件的只有H2、N2、O2、F2、Cl2(稀有气体除外),其中的H2是还原性气体,与题中所说的强氧化性不符,再对余下的4种气体进行验证.题目隐含有两条信息:一是第(2)小题,甲、乙、丙中只有甲由短周期元素组成,言外之意,乙和丙都不是由短周期元素组成,进一步推理:乙、丙可能由第4、5 周期元素组成,中学常见的元素有Fe、Cu、K、Ca、Br、I等.二是由框图中“加入过量丙”和“加入不足量丙”暗示:乙和丙的反应一定是一个多步反应,随着反应物量的比例变化,产物发生变化.结合铁元素有可变化合价,从而可得出所有物质组成.
A是FeBr2,B是FeCl3,C是FeBr3,甲是Cl2,乙是Br2,丙是Fe.
①FeBr2中Fe2+具有还原性,可被Br2氧化为Fe2+,反应的离子方程式为:2Fe2++Br2=2Fe3++2Br-;故答案为:2Fe2++Br2=2Fe3++2Br-;
②C是FeBr3,丙是Fe,Fe把FeBr3的铁还原为亚铁离子,反应方程式为:2Fe3++Fe=3Fe2+故答案为:2Fe3++Fe=3Fe2+;
③A是FeBr2,甲是Cl2,按A与甲的物质的量之比为2:3,氯气把溴化亚铁恰好完全氧化,反应的化学方程式:2FeBr2+3Cl2=2FeCl3+Br2,
离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故答案为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-.
(1)因甲在转化中为还原剂,是常见金属,乙是常见非金属固态单质,且甲、乙、丙都由短周期元素组成,符合此条件的是镁(甲)与二氧化碳(A)发生反应生成氧化镁(B)和碳单质(乙),碳在足量氧气中燃烧生成二氧化碳,在不足量氧气中燃烧生成一氧化碳(C),二氧化碳和碳可化合为一氧化碳.故A为二氧化碳,结构式为:O=C=O,
B为氧化镁,电子式为:
Mg2+
 ,二氧化碳与镁反应的方程式为:2Mg+CO2
,二氧化碳与镁反应的方程式为:2Mg+CO2
| ||
故答案为:O=C=O;Mg2+
 ;2Mg+CO2
;2Mg+CO2
| ||
(2)甲是“非金属”“气态”“单质”,符合这一条件的只有H2、N2、O2、F2、Cl2(稀有气体除外),其中的H2是还原性气体,与题中所说的强氧化性不符,再对余下的4种气体进行验证.题目隐含有两条信息:一是第(2)小题,甲、乙、丙中只有甲由短周期元素组成,言外之意,乙和丙都不是由短周期元素组成,进一步推理:乙、丙可能由第4、5 周期元素组成,中学常见的元素有Fe、Cu、K、Ca、Br、I等.二是由框图中“加入过量丙”和“加入不足量丙”暗示:乙和丙的反应一定是一个多步反应,随着反应物量的比例变化,产物发生变化.结合铁元素有可变化合价,从而可得出所有物质组成.
A是FeBr2,B是FeCl3,C是FeBr3,甲是Cl2,乙是Br2,丙是Fe.
①FeBr2中Fe2+具有还原性,可被Br2氧化为Fe2+,反应的离子方程式为:2Fe2++Br2=2Fe3++2Br-;故答案为:2Fe2++Br2=2Fe3++2Br-;
②C是FeBr3,丙是Fe,Fe把FeBr3的铁还原为亚铁离子,反应方程式为:2Fe3++Fe=3Fe2+故答案为:2Fe3++Fe=3Fe2+;
③A是FeBr2,甲是Cl2,按A与甲的物质的量之比为2:3,氯气把溴化亚铁恰好完全氧化,反应的化学方程式:2FeBr2+3Cl2=2FeCl3+Br2,
离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故答案为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-.
点评:本题对重要的元素及其化合物进行了考查,框图推断题一直是高考中的一种重要题型,试题综合性强,具有一定难度.
本题还对铁元素的可变价态进行了比较隐蔽地考查.要正确作答,需要扎实的基础知识和较强的推理能力,本题是道考查推理能力的好题.
本题易错点:推出乙是碘,因为碘与铁反应只能生成碘化亚铁,碘与铁反应,无论铁的量是不足还是过量,产物只有一种,所以乙不能是碘.
本题还对铁元素的可变价态进行了比较隐蔽地考查.要正确作答,需要扎实的基础知识和较强的推理能力,本题是道考查推理能力的好题.
本题易错点:推出乙是碘,因为碘与铁反应只能生成碘化亚铁,碘与铁反应,无论铁的量是不足还是过量,产物只有一种,所以乙不能是碘.

练习册系列答案
相关题目



 HS-+OH-
HS-+OH- Al(OH)3+3H+有无色气体和白色絮状沉淀产生
Al(OH)3+3H+有无色气体和白色絮状沉淀产生 已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: