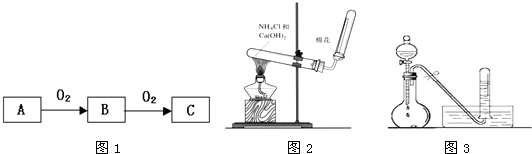
题目内容
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).

(1)若A是一种黄色单质固体,则B→C的化学方程式为
(2)若A是一种活泼金属,C是淡黄色固体,则C中阳离子与阴离子数之比为
 (用双线桥表示电子转移).
(用双线桥表示电子转移).
(3)若C是红棕色气体,则A的化学式可能为

(1)若A是一种黄色单质固体,则B→C的化学方程式为
2SO2+O2
2SO3
| 催化剂 |
| 加热 |
2SO2+O2
2SO3
.| 催化剂 |
| 加热 |
(2)若A是一种活泼金属,C是淡黄色固体,则C中阳离子与阴离子数之比为
2:1
2:1
.试写出C与水反应的化学方程式

(3)若C是红棕色气体,则A的化学式可能为
N2 或NH3
N2 或NH3
.分析:(1)A是一种黄色单质固体,应为S,则B为SO2,C为SO3,生成H2SO4;
(2)A是一种活泼金属,C是淡黄色固体,则A为Na,B为Na2O,C为Na2O2,生成NaOH;
(3)C是红棕色气体,应为NO2,则B为NO,A为N2或NH3 .
(2)A是一种活泼金属,C是淡黄色固体,则A为Na,B为Na2O,C为Na2O2,生成NaOH;
(3)C是红棕色气体,应为NO2,则B为NO,A为N2或NH3 .
解答:解:(1)A是一种黄色单质固体,应为S,则B为SO2,C为SO3,SO2在催化剂条件下生成SO3,
反应的方程式为2SO2+O2
2SO3,
故答案为:2SO2+O2
2SO3;
(2)A是一种活泼金属,C是淡黄色固体,则A为Na,B为Na2O,C为Na2O2,Na2O2中阳离子与阴离子数之比为2:1,
Na2O2与水反应时自身发生氧化还原反应,反应的方程式以及电子转移可为 ,
,
故答案为:2:1; ;
;
(3)C是红棕色气体,应为NO2,则B为NO,N2或NH3 都可生成NO,则A可能为N2或NH3 ,
故答案为:N2或NH3 .
反应的方程式为2SO2+O2
| 催化剂 |
| 加热 |
故答案为:2SO2+O2
| 催化剂 |
| 加热 |
(2)A是一种活泼金属,C是淡黄色固体,则A为Na,B为Na2O,C为Na2O2,Na2O2中阳离子与阴离子数之比为2:1,
Na2O2与水反应时自身发生氧化还原反应,反应的方程式以及电子转移可为
 ,
,故答案为:2:1;
 ;
;(3)C是红棕色气体,应为NO2,则B为NO,N2或NH3 都可生成NO,则A可能为N2或NH3 ,
故答案为:N2或NH3 .
点评:本题考查无机物的推断,题目难度不大,本题注意根据物质的颜色判断物质的可能性,易错点为氧化还原反应,注意电子的转移方向.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 HS-+OH-
HS-+OH- Al(OH)3+3H+有无色气体和白色絮状沉淀产生
Al(OH)3+3H+有无色气体和白色絮状沉淀产生 已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: