题目内容
【题目】有六种短周期元素,已知A的单质是最清洁的能源物质,其他元素的原子半径及主要化合价如下表:
元素代号 | B | C | D | E | F |
原子半径/nm | 0.186 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +1 | +3 | +6、-2 | +7、-1 | -2 |
根据上述信息回答以下问题。
(1)D在元素周期表中的位置______________;E的离子结构示意图______________。
(2)关于A元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,试分析其理由________________________________。
(3)用电子式表示B的单质与D的单质形成化合物的过程________________________。
(4)下列各项比较,正确的是________________________。
①氢化物的沸点:D低于F ②A~F元素的简单离子半径:C的最大
③气态氢化物稳定性:D比E稳定 ④最高价氧化物对应的水化物碱性:B小于C
(5)E单质常用于自来水消毒。用必要的文字和离子方程式解释原因______________________________________________________________。
(6)写出C的单质与B的最高价氧化物的水化物反应的离子方程式________________。
(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,该反应的化学方程式为________________________________。
(8)已知单质M的燃烧热为375kJ/mol,写出表示其燃烧热的热化学方程式___________________________。
(9)已知NH3结合质子的能力强于F的氢化物,请用最恰当的离子方程式证明这个结论________________________________。
【答案】 第三周期,第ⅥA族 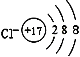 氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构)
氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构) ![]() ① Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒 2Al+2OH-+2H2O=2AlO2- +3H2↑ 2Al+Fe2O3
① Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒 2Al+2OH-+2H2O=2AlO2- +3H2↑ 2Al+Fe2O3![]() Al2O3+2Fe Fe(s)+2/3 O2(g)=1/3 Fe3O4(s)ΔH=-375kJ/mol NH3 + H3O+=NH4+ + H2O
Al2O3+2Fe Fe(s)+2/3 O2(g)=1/3 Fe3O4(s)ΔH=-375kJ/mol NH3 + H3O+=NH4+ + H2O
【解析】已知A的单质是最清洁的能源物质,A是H;根据元素的原子半径及主要化合价可知D一定是S,E一定是Cl,F一定是O,则B一定是Na,C一定是Al。
(1)S在元素周期表中的位置是第三周期第ⅥA族;Cl-离子结构示意图为 。(2)由于氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构),因此有人主张把它放在第ⅦA族。(3)B的单质与D的单质形成的化合物是离子化合物硫化钠,其形成过程可表示为
。(2)由于氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构),因此有人主张把它放在第ⅦA族。(3)B的单质与D的单质形成的化合物是离子化合物硫化钠,其形成过程可表示为![]() 。(4)①水分子间存在氢键,则氢化物的沸点:D低于F,正确;②离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则A~F元素的简单离子半径:S的最大,错误;③氯元素非金属性强于硫,气态氢化物稳定性:E比D稳定,错误;④钠的金属性强于铝,最高价氧化物对应的水化物碱性:B大于C,错误,答案选①;(5)Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒。(6)铝单质与B的最高价氧化物的水化物氢氧化钠反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,即铝与氧化铁发生的铝热反应,该反应的化学方程式为2Al+Fe2O3
。(4)①水分子间存在氢键,则氢化物的沸点:D低于F,正确;②离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则A~F元素的简单离子半径:S的最大,错误;③氯元素非金属性强于硫,气态氢化物稳定性:E比D稳定,错误;④钠的金属性强于铝,最高价氧化物对应的水化物碱性:B大于C,错误,答案选①;(5)Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒。(6)铝单质与B的最高价氧化物的水化物氢氧化钠反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,即铝与氧化铁发生的铝热反应,该反应的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。(8)已知铁的燃烧热为375kJ/mol,则表示其燃烧热的热化学方程式为Fe(s)+2/3O2(g)=1/3Fe3O4(s)ΔH=-375kJ/mol。(9)根据反应NH3+H3O+=NH4++H2O可说明NH3结合质子的能力强于水。
Al2O3+2Fe。(8)已知铁的燃烧热为375kJ/mol,则表示其燃烧热的热化学方程式为Fe(s)+2/3O2(g)=1/3Fe3O4(s)ΔH=-375kJ/mol。(9)根据反应NH3+H3O+=NH4++H2O可说明NH3结合质子的能力强于水。