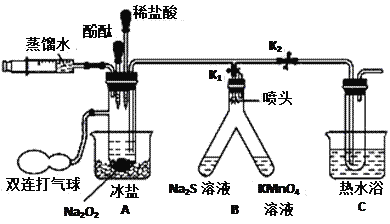
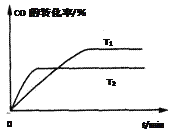
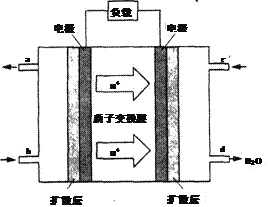
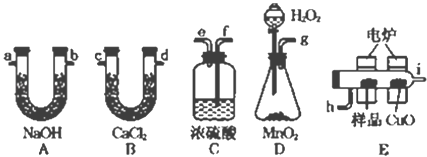
题目内容
【题目】(1)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_____、_______、________。
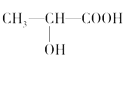
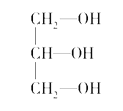
(2)下列分子中若有手性原子,请用“*”标出其手性碳原子。____________
(3)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填序号)________________。
(4)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):HClO3________HClO4;
(5)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的立体构型为_______________。
【答案】 Co3+ CN- 6 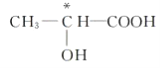 ①③④⑦ < V形
①③④⑦ < V形
【解析】(1)根据配合物的结构简式可知,在配合物K3[Co(CN)6]中的中心离子是Co3+,配位体是CN-,配位数是6;(2)如果饱和碳原子连接的4个原子或基团各不相同,则该碳原子就是手性碳原子,所以含有手性碳原子的是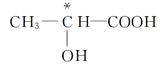 ;
;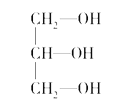 不含有手性碳原子;(3)①CO2中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;②NH3中C元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子;③CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;④BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子;⑤H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,为极性分子;⑥SO2中S元素化合价为+4,S原子最外层6个电子未全部成键,为极性分子;⑦SO3中S元素化合价为+6,S原子最外层6个电子全部成键,为非极性分子;⑧PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,为极性分子;答案选①③④⑦;(4)含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强,所以含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越强,则酸性:HClO3<HClO4;(5)因为I3+可看成II2+,所以根据价层电子对互斥理论可知,I3+中中心原子含有的孤对电子对数=
不含有手性碳原子;(3)①CO2中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;②NH3中C元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子;③CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;④BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子;⑤H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,为极性分子;⑥SO2中S元素化合价为+4,S原子最外层6个电子未全部成键,为极性分子;⑦SO3中S元素化合价为+6,S原子最外层6个电子全部成键,为非极性分子;⑧PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,为极性分子;答案选①③④⑦;(4)含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强,所以含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越强,则酸性:HClO3<HClO4;(5)因为I3+可看成II2+,所以根据价层电子对互斥理论可知,I3+中中心原子含有的孤对电子对数=![]() =2,所以其空间构型为V形。
=2,所以其空间构型为V形。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】有关煤、石油和天然气的综合利用,下列说法正确的是
A.水煤气主要成分是CH4
B.煤的气化和液化、石油的分馏都是物理变化
C.裂解的目的是提高汽油的产量和质量
D.鉴别直馏汽油和裂化汽油,可用溴水鉴别
【题目】有六种短周期元素,已知A的单质是最清洁的能源物质,其他元素的原子半径及主要化合价如下表:
元素代号 | B | C | D | E | F |
原子半径/nm | 0.186 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +1 | +3 | +6、-2 | +7、-1 | -2 |
根据上述信息回答以下问题。
(1)D在元素周期表中的位置______________;E的离子结构示意图______________。
(2)关于A元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,试分析其理由________________________________。
(3)用电子式表示B的单质与D的单质形成化合物的过程________________________。
(4)下列各项比较,正确的是________________________。
①氢化物的沸点:D低于F ②A~F元素的简单离子半径:C的最大
③气态氢化物稳定性:D比E稳定 ④最高价氧化物对应的水化物碱性:B小于C
(5)E单质常用于自来水消毒。用必要的文字和离子方程式解释原因______________________________________________________________。
(6)写出C的单质与B的最高价氧化物的水化物反应的离子方程式________________。
(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,该反应的化学方程式为________________________________。
(8)已知单质M的燃烧热为375kJ/mol,写出表示其燃烧热的热化学方程式___________________________。
(9)已知NH3结合质子的能力强于F的氢化物,请用最恰当的离子方程式证明这个结论________________________________。