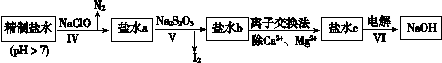
��Ŀ����
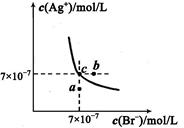
��֪������AgCl��Ksp��1.8��10��10��AgI��Ksp��8.5��10��17������5mL����KCl��KI��Ϊ0.01mol/L�Ļ����Һ�м���8mL 0.01mol/L AgNO3��Һ����ʱ��Һ���������ʵ�����Ũ�ȴ�С��ϵ��ȷ����
| A��c��K+����c��NO3������c��Cl������c��Ag+����c��I���� |
| B��c��K+����c��NO3������c��Ag+����c��Cl������c��I���� |
| C��c��NO3������c��K+����c��Ag+����c��Cl������c��I���� |
| D��c��K+����c��NO3������c��Ag+����c��Cl������c��I���� |
A
����������ڻ����Һ�к��и������ӵ����ʵ���Ϊ��c(K+)=(0.02mol/L��0.005L)��0.013L=7.7��10-3mol/L;c(NO3-)=(0.01mol/L��0.008L)��0.013L=6.15��10-3mol/L; c(Ag+)=(0.01mol/L��0.008L) ��0.013L ="6.15" �� 10-3mol/L; c(Cl-)=c(I-)="(0.01mol/L��0.005L)" ��0.013L =3.85��10-3mol/L;����c(Ag+)��c(I-)= 6.15��10-3mol/L ��3.85��10-3mol/L =2.37��10-6>1.8��10��10 >8.5��10��17,���������γ�AgI������������1:1��ϵ�γɳ�����c(Ag+) ��c(Cl-)=(6.15-3.85)��10-3mol/L��3.85��10-3mol/L=8.8610-6>1.8��10��10 =Ksp(AgCl),���γ�AgCl������������1:1��ϵ�γɳ��������Է�Ӧ����Һ�е�����Ũ�ȹ�ϵΪc(K+)> c(NO3-)> c(Cl-)> c(Ag+)> c(I-)��ѡ��ΪA��

��ϰ��ϵ�д�
�����Ŀ
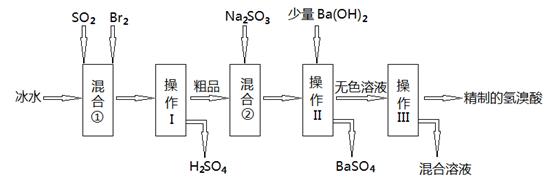
 AgBr(s)+Cl-(aq)ƽ�ⳣ������816
AgBr(s)+Cl-(aq)ƽ�ⳣ������816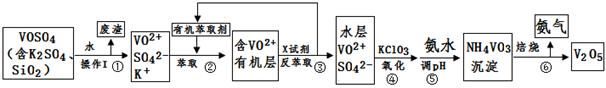
 2RAn���л��㣩 + nH2SO4 (ˮ��)
2RAn���л��㣩 + nH2SO4 (ˮ��)