题目内容
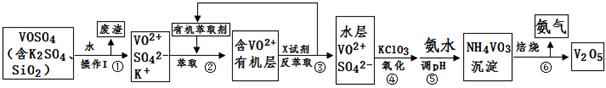
(15分)工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层)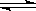 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
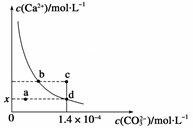
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。〖已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39〗
(5)该工艺流程中,可以循环利用的物质有 和 。

请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层)
 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层) ②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
(5)该工艺流程中,可以循环利用的物质有 和 。
(1)SiO2,过滤;(2)加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率,H2SO4
(3)6VO2++ClO3-+9H2O=6VO3-+Cl-+18H+;(4)1.7~1.8 ,26×10-3mol/L;
(5)氨气(或氨水),有机萃取剂
(3)6VO2++ClO3-+9H2O=6VO3-+Cl-+18H+;(4)1.7~1.8 ,26×10-3mol/L;
(5)氨气(或氨水),有机萃取剂
试题分析:(1)在K2SO4、SiO2、VOSO4中只有SiO2不能在水中溶解,因此步骤①所得废渣的成分是SiO2。将难溶性固体与溶液分离的操作是过滤。因此操作I的名称为过滤。(2)②中萃取时必须加入适量碱,其原因是加入碱中和前边反应产生的硫酸,促使平衡正向移动,提高钒的萃取率,③中X试剂为H2SO4。(3)在含有VO2+、SO42-的水在加入氧化剂KClO3可以把+4价的VO2+氧化为+5价的VO3-。因此根据电荷守恒及电子守恒,结合质量守恒定律,可知该步骤的离子方程式为6VO2++ClO3-+9H2O =6VO3 -+Cl-+ 18H+;(4)根据25℃时,钒沉淀率和溶液pH之间关系表格数据可知zai pH为1.7、1.8时钒沉淀率最高。因此调节溶液的最佳pH为1.7~1.8,若钒沉淀率为93.1%,则pH="2.0," c(H+)=10-2mol/L, c(OH-)=10-12,此时不产生Fe(OH)3沉淀,根据Ksp[Fe(OH)3]=2.6×10-39,则溶液中c(Fe3+)< Fe(OH)3÷c3(OH-) =2.6×10-39 ÷(10-12)3=2.6×10-3mol/L。(5)根据流程示意图可知:该工艺流程中,可以循环利用的物质有氨气(或氨水)和有机萃取剂。

练习册系列答案
相关题目