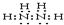题目内容
4.向NaOH和Na2CO3的混合溶液(其物质的量浓度相等)中加入盐酸后,下列离子方程式与事实不相符的是( )| A. | CO32-+OH-+2H+═HCO3-↑+H2O | B. | CO32-+2OH-+3H+═HCO3-+2H2O | ||
| C. | CO32-+2OH-+4H+═CO2↑+3H2O | D. | CO32-+OH-+3H+═CO2↑+2H2O |
分析 等物质的量浓度的NaOH和Na2CO3的混合溶液中含有氢氧化钠与碳酸钠的物质的量相等,稀盐酸加入到NaOH和Na2CO3的混合溶液中,盐酸先与氢氧化钠发生酸碱中和,剩余的盐酸再与碳酸钠发生反应,盐酸少量时发生反应CO32-+H+→HCO3-,盐酸过量时发生反应:CO32-+2H+→CO2↑+H2O,据此进行解答.
解答 解:根据题意可知,等物质的量浓度的NaOH和Na2CO3的混合溶液中,含有的氢氧化钠与碳酸钠的物质的量相等,稀盐酸加入到NaOH和Na2CO3的混合溶液中,盐酸先与氢氧化钠发生酸碱中和,剩余的盐酸再与碳酸钠发生反应,
A.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸少量,先发生反应:OH-+H+→H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应CO32-+H+→HCO3-,将两个方程式相加得:CO32-+OH-+2H+═HCO3-↑+H2O,故A正确;
B.设NaOH和Na2CO3的物质的量都为2mol,则加入盐酸少量,先发生反应:2OH-+2H+→2H2O,2mol氢氧化钠消耗2mol盐酸,再发生反应CO32-+H+→HCO3-,盐酸不足之消耗1mol碳酸钠,将两个方程式相加得:CO32-+2OH-+3H+═HCO3-+2H2O,故B正确;
C.设NaOH和Na2CO3的物质的量都为2mol,2mol氢氧化钠消耗2mol氢离子,剩余2mol氢离子与2mol碳酸钠反应生成2mol碳酸氢根离子,离子方程式应为2OH-+2CO32-+4H+→2HCO3-+2H2O,即OH-+CO32-+2H+=HCO3-+H2O,故C错误;
D.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸过量,先发生反应:OH-+H+→H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应CO32-+2H+→CO2↑+H2O,将两个方程式相加得:OH-+CO32-+3H+=CO2↑+2H2O,故D正确;
故选C.
点评 本题考查了离子方程式的书写,题目难度中等,明确氢氧根离子、碳酸根离子与氢离子反应的顺序和过程是解题关键,注意反应物的量对生成物的影响.

| A. | 每摩尔-CH3中含10NA个电子 | |
| B. | 每摩尔CnH2n+2中,碳原子与碳原子形成的共用电子对数目为nNA | |
| C. | 14g乙烯和丙烯的混合气体中含有H原子数为2NA | |
| D. | 每摩尔苯中含有的碳氢单键的数目为6NA |
| A. | CH3OH和CH3OCH3 | B. | HCOOH和C17H33COOH | ||
| C. | CH3CH2CH2Br和CH3CHBrCH3 | D. |  和 和 |
| A. | 原子半径:O>N>C | B. | 热稳定性:H2O>HF>H2S | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 酸性:H3PO4>H2SO4>HClO4 |
| A. | 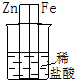 | B. | 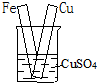 | C. | 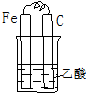 | D. | 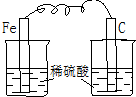 |
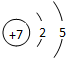 ;
;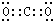 .
.